
Соосаждение церия, лантана и иттрия с сульфатом калия (В.И. Гребенщикова, В.Н. Боброва)
Соосаждение элементов второй группы периодической системы с кристаллическим осадком сульфата калия наблюдали Хан [1], Хлопин [2] и Меркулова [3-5]. Они пришли к выводу, что соосаждение двувалентных элементов с сульфатом калия обусловлено внутриадсорбционным захватом.
При изучении соосаждения La, Се(III) и Y с K2SO4 нами было показано, что исследуемые системы не подчиняются закономерностям, наблюдаемым при внутриадсорбционном захвате радиоэлементов - захват церия и лантана не зависит от условий роста кристаллов K2SO4 и от присутствия в растворе посторонних ионов (Pu4+, Am3+, Fe3+ и Аl3+) [6].
При детальном исследовании соосаждения La, Се и Y с K2SO4 было установлено, что величина коэффициента кристаллизации имеет постоянное значение при различном соотношении твердой и жидкой фаз, независимо от методов его определения; при достижении равновесия "сверху" и "снизу" и методом частичной перекристаллизации твердой фазы; при изменении концентрации микрокомпонента в интервале от 10-6 до 10-10 мол/л.
Таким образом, соосаждение Се, La и Y с K2SO4 обусловлено образованием аномальных смешанных кристаллов без нижней границы смешиваемости [7].
Дальнейшее изучение равновесий между аномальными смешанными кристаллами и раствором, а также скорости перекристаллизации макрокомпонента в различных условиях позволило подойти к механизму образования смешанных кристаллов. Проведенные опыты показали, что адсорбированные осадком K2SO4 ионы церия или лантана практически не десорбируются раствором, насыщенным K2SO4, и скорость перекристаллизации осадка K2SO4 после адсорбции на поверхности лантана или церия резко замедляется [7]. Изменение скорости перекристаллизации осадка можно объяснить образованием в активных местах роста кристаллов K2SO4 прочных химических соединений, которые препятствуют перекристаллизации осадка.
Известно, что рзэ образуют с K2SO4 двойные соли. Авторами было установлено, что при увеличении концентрации микрокомпонента лантана или церия из исследуемых растворов выпадают соли двойных сульфатов: KsLa(SO4)4 и KsCe(SO4)4* [8]. Двойной сульфат калия и иттрия получить не удалось, очевидно, вследствие большой его растворимости.
* (Формула выделяющихся двойных сульфатов установлена на основании данных химического анализа и может быть выражена как 5K2SO4 × Ln2(SO4)3, согласно имеющимся в литературе данным о комплексном характере двойных сульфатов мы пользуемся выоажением K5Ln(SO4)4, где Ln = Се, La.)
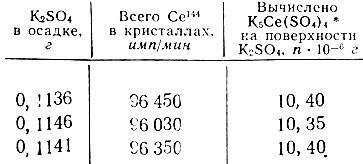
Таблица 2. Насыщение поверхности K2SO4 церием путем восьми последовательных адсорбций
* (12 800 имп/мин Се104 соответствует 1,38 × 10-6 г K5La(SO4)4. )
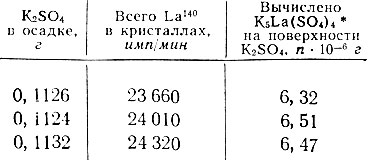
Таблица 2. Насыщение поверхности K2SO4 лантаном путем четырех последовательных адсорбций
* (11 640 имп/мин La140 соответствует 3,09 × 10-6 г K5Ce(SO4)4. )
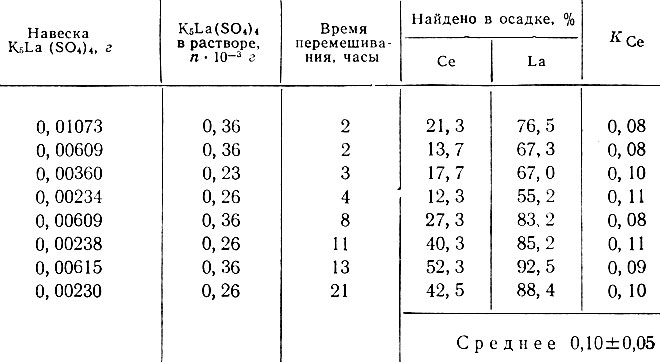
Таблица 3. Определение коэффициента распределения Се (III) методом частичной перекристаллизации осадка Се (III) - K5La(SO4)4/0,5 N HNO3
Можно было предположить, что при адсорбции La, Се и Y осадком K2SO4 в активных местах поверхности образуются двойные сульфаты того же состава, что и в насыщенном растворе K2SO4. Косвенным доказательством этого предположения является установленная связь между значением коэффициента кристаллизации микрокомпонента и величиной растворимости двойного сульфата: наименьшей растворимости образующегося двойного сульфата соответствует наибольшее значение коэффициента кристаллизации радиоэлемента [9].
Прямым доказательством образования на поверхности K2SO4 двойных сульфатов K5La(SO4)4 и K5La(SO4)4 было бы равенство коэффициентов кристаллизации церия в системах Се(III)-осадок K5La(SO4)4; Се(III) - осадок K2SO4 после адсорбции на нем лантана; La - осадок K5Ce(SO4)4; La - осадок K2SO4 после адсорбции на нем Се (III). С этой целью предварительно были получены как осадки чистых двойных сульфатов, так и осадки K2SO4, насыщенные по поверхности Се144 и La140 (табл. 1 и 2).

Таблица 4. Определение коэффициента распределения La методом частичной перекристаллизации осадка La - K5Ce(SO4)4 - K2SO4 - 0,5 N HNO3

Таблица 5. Определение коэффициента распределения лантана между кристаллами K2SO4, адсорбировавшими Се (III), и раствором K2SO4. В исходный раствор введен La140 (165 × 103 имп/мин)
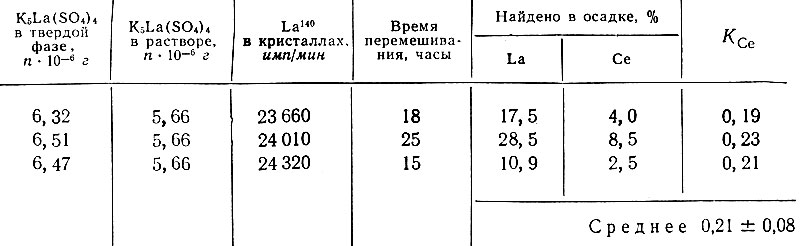
Таблица 6. Определение коэффициента распределения Се (III) между кристаллами K2SO4, адсорбировавшими La и раствором K2SO4. В исходный раствор введен Ce144 (165 × 103 имп/мин)

Таблица 7. Сопоставление величин коэффициентов кристаллизации Се (III) и La в изучаемых системах
Ввиду плохой растворимости двойных сульфатов в насыщенных растворах K2SO4 коэффициенты кристаллизации Се (III) и La определяли методом частичной перекристаллизации твердой фазы (табл. 3-6). Количество твердой фазы, находящейся в равновесии с раствором, определяли по La140 для K5La(SO4)4 и по изотопу Се144 для K5Ce(SO4)4 [10]. Полученные значения коэффициентов кристаллизации Се(III) и La с осадком K2SO4, покрытым по поверхности La или Се(III), резко отличаются от значений коэффициентов кристаллизации La и Се(III) с K2SO4 и приближаются к значениям коэффициентов кристаллизации, полученным для двойных солей (см. табл. 7). Мы считаем, что полученные результаты являются подтверждением того, что при адсорбции Се (III) и La на поверхности кристаллов K2SO4 действительно образуются двойные сульфаты того же состава, который имеют двойные соли калия и лантана, а также калия и церия, выпадающие из насыщенного раствора K2SO4 при увеличении концентрации церия и лантана в растворе.
Таким образом, при соосаждении Се(III) и La с K2SO4 аномальные смешанные кристаллы образуются путем сокристаллизации двойных сульфатов K5Ce(SO4)4 и K5La(SO4)4 с K2SO4.
Литература
- О. Хав Прикладная радиохимия. М.- Л., Госхимиздат, 1957, стр. 109.
- В. Г. Хлопин. Тр. Гос. радиевого ин-та, № 4. М.- Л., ГОНТИ, 1938, стр. 34.
- М. С. Меркулова, В. Н. Частухина, Л. Н. Бурцева. ДАН СССР, 102, 6 (1955).
- М. С. Меркулова, Т. С. Инвелкина. ДАН СССР, 103, 457 (1955).
- М. С. Меркулова, С. А. Потапова. ДАН СССР, 103, 643 (1955).
- В. И. Гребенщикова, В. Н. Боброва. ЖНХ, 3, 41 (1958).
- В. И. Гребенщикова, В. Н. Боброва. Радиохимия, 3, 377 (1961).
- В. И. Гребенщикова, В. Н. Боброва. Радиохимия, 3, 500 (1961).
- В. И. Гребенщикова, В. Н. Боброва. Радиохимия, 3, 385 (1961).
- В. И. Гребенщикова, Р. В. Брызгалова. ЖНХ, 3, 36 (1958).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'