
Соосаждение скандия, европия и лантана с гидроокисью железа (В.И. Гребенщикова, А.Ф. Прокудина)
Вопросу сорбции из раствора радиоэлементов гидроокисями посвящено много работ, однако единого мнения о механизме захвата не существует. Первичная обменная адсорбция катионов [1-3], обмен катиона микроэлемента с ионами водорода гидроксильной группы гидроокиси сорбента [4], хемосорбция [1, 2], совместное осаждение коллоидных частиц гидроокисей сорбента и сорбируемого элемента [5] - предположения, которые наиболее часто высказываются о механизме сорбции.
С целью выяснения механизма этого явления изучали сорбцию Sc, Eu и La на гидроокиси железа. Работу проводили на готовой состарившейся суспензии Fe(OH)3 по методике, применяемой при изучении адсорбции на кристаллических осадках [6]. Стеклянную поверхность посуды предварительно насыщали элементом, сорбцию которого изучали.
Суспензия Fe(OH)3 характеризовалась следующими данными:
Размер частиц - 200-300 А; заряд поверхности: до pH > 7 - положительный, при pH > 7 - отрицательный; мзоэлектрическая точка лежит в области pH 6,9-7; pH суспензии составляет 6,2 (величина pH сохраняется постоянной в течение длительного времени - примерно полтора года).
Элементы Sc, Eu и La гидролизуются при разных значениях pH [7, 8] и имеют удобные радиоактивные изотопы [9]. Характеристика последних дана в таблице.

Характеристика применяемых изотопов
Для Sc, Eu и La была изучена зависимость величины сорбции от pH раствора, а также от количества твердой фазы Fe(OH)3. Экспериментальные данные изображены графически (рис. 1-6). Полученный экспериментальный материал по изучению зависимости величины сорбции от количества гидроокиси железа (рис. 1-3) показывает, что начало сорбции и ее максимальное значение для каждого из этих элементов наблюдаются при разных значениях pH. Sc и Ей начинают сорбироваться при pH > 4, La - при pH > 5. Для всех трех элементов имеются значения pH*, при которых наблюдается линейный ход зависимости сорбции от количества Fe(OH)3. Отклонение от линейной зависимости происходит при значениях pH, близких к pH начала осаждения этих элементов. Так как pH раствора - одна из наиболее важных характеристик, определяющих состояние элемента в растворе, можно предположить, что различный характер зависимости сорбции от количества Fe(OH)3 при разных значениях pH раствора связан с различным механизмом сорбции каждой формы ионов в растворе.
* (pH растворов измеряли стеклянным электродом, включенным в схему лампового потенциометра типа ЛП-5, с точностью ± 0,1 единицы pH. Активность образцов измеряли на установке типа В с точностью 3-5%. Приведенные данные - это средние значения 5-10 параллельных опытов)
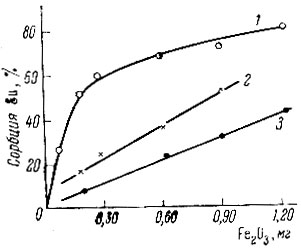
Рис. 1. Зависимость сорбции Еu от количества гидроокиси железа для различных значений pH: 1 - 6,2; 2 - 4,9; 3 - 4,2. Концентрация Еu - 4 × 10-5 M; время контакта с Fe(OH)3 - 30 мин. при 20° С
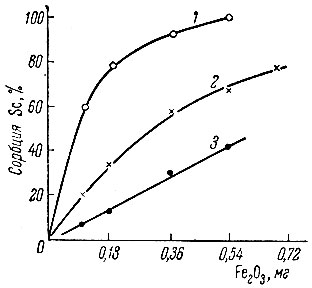
Рис. 2. Зависимость сорбции Sc от количества гидроокиси железа для различных значений pH: 1 - 6,2; 2 - 4,9; 3 - 4,2. Концентрация Sc - 4 × 10-5 M; время контакта с Fe(OH)3 - 30 мин. при 20° С
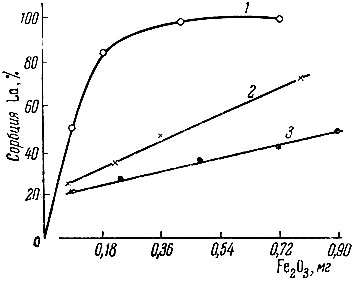
Рис. 2. Зависимость сорбции La от количества гидроокиси железа для различных значений pH: 1 - 6,2; 2 - 4,9; 3 - 4,2. Концентрация La - 4 × 10-5 M; время контакта с Fe(OH)3 - 30 мин. при 20° С
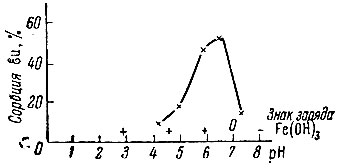
Рис. 4. Зависимость сорбции Еu от pH раствора. Концентрация Еu - 4-10-5 М; время контакта с Fe(OH)3 - 30 мин
При рассмотрении зависимости сорбции от pH раствора (рис. 4-6) наблюдается наличие максимумов для всех трех изучаемых элементов. Весьма характерно, что как начало сорбции, так и максимумы сорбции для Sc и Ей лежат в области положительного знака заряда поверхности Ре(ОН)3; значительное количество лантана также адсорбируется на положительно заряженной поверхности.
Полученные результаты существенны для выяснения механизма сорбции, так как они однозначно указывают на отсутствие связи между величиной захвата Sc, Eu, La и зарядом поверхности адсорбента Fe(OH)3, что позволяет исключить возможность захвата изучаемых элементов вследствие вторичной адсорбции.
Максимумы на кривых сорбции в зависимости от pH раствора также нельзя объяснить выделением твердой фазы Sc(OH)3, Eu(OH)3, La(OH)3, так как величина произведения растворимости для изучаемых нами концентраций (они значительно ниже концентраций, чем те, для которых было определено ПР|) будет достигаться при более высоких значениях pH раствора: для скандия - при pH ∼ 7 (вместо pH 4,9); для европия - при pH ∼ 8 (вместо pH 6,8); для лантана - при pH ∼ 9 (вместо pH 7,8). Максимумы же сорбции для всех трех изучаемых элементов лежат до pH начала образования ими твердой фазы. Из сопоставления полученных данных, приведенных на рис. 1-6, следует, что сорбция гидроокисью железа, очевидно, обусловлена химическим взаимодействием гидроксильных групп, входящих в состав Fe(OH)3 с гидролизованными ионами рзэ, например, Ln(OH)2+ , Ln(OH)+2.
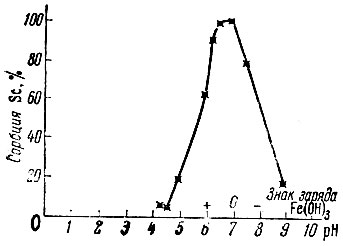
Рис. 5. Зависимость сорбции Sc от pH раствора. Концентрация Sc - 2 × 10-5 М; время контакта с Fe(OH)3 - 30 мин. при 20° С
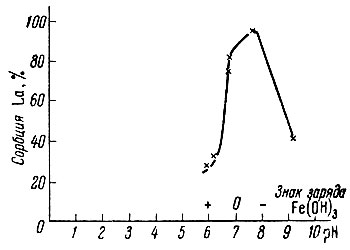
Рис. 6. Зависимость сорбции La от pH раствора. Концентрация La - 2 × 10-5 М; время контакта с Fe(OH)3 - 30 мин. при 20° С
При более глубоком гидролизе рзэ вероятность образования на поверхности Fe(OH)3 молекул типа Ln(OH)3, видимо, возрастает. Одновременно с этим при переходе к более высоким значениям pH уменьшается и способность к диссоциации образовавшихся на поверхности сорбента гидроокисей Ln(OH)3. В случае химического взаимодействия ионов с поверхностью Fe(OH)3 до определенного значения pH раствора оба фактора будут приводить к увеличению захвата рзэ, что и наблюдается на опыте.
Падение сорбции с увеличением концентрации гидроксильных ионов в растворе можно объяснить многими факторами, например, образованием не диссоциированных молекул Ln(OH)3, различным типом полимеров [10], образованием коллоидов.
На участке pH начала сорбции, очевидно, наблюдается другой механизм сорбции - по-видимому, обмен катионов рзэ и ионов водорода на поверхности Fe(OH)3, что следует из данных, приведенных на рис. 1-3 (кривые 2, 3).
Таким образом, в зависимости от условий эксперимента могут преобладать различные виды сорбции, чем можно до некоторой степени объяснить существование различных точек зрения на характер сорбции гидроокисями. Так, при частичном осаждении гидроокиси железа в присутствии элементов, гидролизующихся при больших значениях pH, чем pH осаждения Fe(OH)3 (pH 2-3), преобладающим будет обменный механизм. Если же pH осаждения соответствует области гидролиза сорбируемого элемента, то в основном будет наблюдаться хемосорбция.
Экспериментальные данные, опубликованные в литературе, не противоречат высказанным предположениям о механизме сорбции рзэ гидроокисью железа.
Резюмируя изложенное, считаем, что для элементов, склонных к гидролизу, не существует единого механизма захвата Fe(OH)3 для всех значений pH раствора. В области pH, когда образуются гидролизованные ионы, наблюдается максимальная сорбция, и механизм сводится к химическому взаимодействию на поверхности Fe (ОН) 3 гидроксильных ионов, входящих в состав Fe(OH)3 с ионами типа Ln(OH)+2 При значениях pH, при которых наблюдается линейный ход зависимости сорбции от количества Fe(OH)3, по-видимому, имеет место обменный характер захвата.
Литература
- В. В. Пушка рев. ЖНХ, 1, 178 (1956).
- С. А. Вознесенский, В. В. Пушкаре в, В. Ф. Багрецов. ЖНХ, 3, 235 (1958).
- В. Т. Чуйко, Н. П. Дьяченко. Тр. Тернопольск. мед. ин-та, 1, 477 (I960).
- Z. Ко lari k, V. Kovrim. Coll. Czech., Chem. Comm., 25, 1000 (1960).
- А. К. Лаврухин а. ЖАХ, 22, 41 (1957).
- А. П. Pатнep. Диссертация. Радиевый ин-т АН СССР, 1948.
- Th. Moeller, Н. Е. Kremers. J. Phys. Chem., 48, 395 (1944!).
- Th. Moeller, H. E. Kremers. Chem. Rev., 37, 97 (1945).
- A. H. Несмеянов, А. В. Лапицкий, H. П. Руденко. Получение радиоактивных изотопов. М., Госхимиздат, 1954.
- G. Biedermann, М. Kilpatrick, L. Роkrеs, L. G. Sillеn. Acta Chem. Scand., 10, 1327 (1956).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'