
Смешанные гексанитроникелаты редкоземельных и щелочных элементов (Г.П. Александров, В.С. Тихонова)
Гексанитроникелаты - производные гипотетической комплексной кислоты H4[Ni(NO2)6]. Известны соли этой кислоты с К, Rb и Cs [1], а также со Sr, Вa и Рb [2]. Рзэ образуют ряд смешанных гексанитроникелатов с одновалентными катионами большого ионного радиуса (NH4, К, Rb, Cs, Т1). Однако эти соединения мало изучены, особенно те, которые содержат редкие щелочные металлы.
Смешанным гексанитроникелатам рзэ и щелочных металлов приписывают самый разнообразный состав. Так, Кутика и Галло [3] предложили для гексанитроникелатов церия и калия формулу 3Ce(NO2)3 × 5Ni(NO2)2 × 13KNO2. Другие авторы [4] такому же соединению приписали состав, соответствующий формуле KsCe[Ni(NO2)6]2. При изучении свойств смешанных гексанитроникелатов лантана и церия с калием были установлены [5] формулы для лантана 3KLa[Ni(NO2)6] × 4K4[Ni(NO2)6] и церия 3KCe[Ni(NO2)6] × 5K4[Ni(NO2)6]. Тананаевым и Лютой [6, 7] были выделены смешанные гексанитроникелаты рзэ и калия, соответствующие формулам К6Ln[Ni(NО2)6]3, K21Ln5 × [Ni(NO2)6]9 и K5Ln[Ni(NO2)6]2, где Ln - La, Pr, Nd, Y, Yb. Соединениям церия с рубидием и цезием приписывали следующие формулы: Rb5Ce[Ni(NO2)6]2 и Cs5Ce[Ni(NO2)6]2 [8]. Сведений о других смешанных гексанитроникелатах рзэ со щелочными металлами в литературе нет.
Проведенными ранее исследованиями [9] смешанных гексанитроникелатов лантана и церия с калием было установлено, что они имеют переменный состав, соответствующий формуле mKLn[Ni(NO2)6] × nK4[Ni(NO2)6], в которых величина n/m может изменяться от 0,66 до 1,85 для лантана и от 0,66 до 1,56 - для церия в зависимости от исходной концентрации взятых веществ.
Был изучен состав смешанных гексанитроникелатов La, Се, Pr, Nd, Sm, Y с К, Rb, Cs в зависимости от изменения концентрации [Ni(NO2)6]4- в исходном растворе. Одновременно были изучены также некоторые физические свойства выделенных смешанных солей (показатели преломления, плотности и параметры кристаллической решетки кристаллов).
Смешанные гексанитроникелаты рзэ и калия были синтезированы из нитратов рзэ и K4[Ni(NO2)6]. При сливании концентрированных растворов солей образуется мелкокристаллический осадок смешанных гексэ нитроникелатов рзэ и калия, не растворимый в избытке осадителя, но растворимый в воде.
Образование этих соединений можно представить следующим образом:
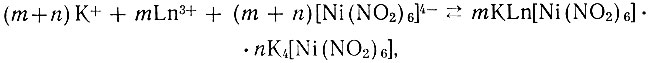
где Ln3+ - La, Ce, Pr, Nd, Sm, Gd и Y.
Смешанные гексанитроникелаты рзэ с рубидием и цезием получали аналогично соединением калия, но исходили при этом из нитратов рзэ, Rb или Cs и Ni в присутствии избытка NaNO2 как источника нитрит- ионов. Реакция в данном случае, по-видимому, протекает по схеме:
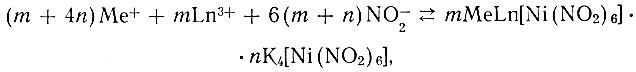
где Me - Rb, Cs; Ln - La, Nd, Sm, Y.
Подобно соединениям лантана и церия, соли остальных рзэ с К, Rb и Cs - светло-коричневые соединения кубической сингонии, растворимые в воде. Смешанные соли получали при перемешивании раствора исходных веществ в течение 5-6 час. Кристаллы гексанитроникелатов отфильтровывали через воронку со стеклянным фильтром и дополнительно отжимали между листами фильтровальной бумаги при давлении 250 кГ/см2, после чего высушивали в вакуум-сушильном шкафу при комнатной температуре и анализировали. Рзэ определяли оксалатным методом, никель - с диметилглиоксимом, нитриты - иодометрически. В отдельных случаях К, Rb и Cs в смешанных солях определяли перхлоратным методом, а присутствующие в некоторых смешанных солях нитраты - нитроном. Формулу смешанных гексанитроникелатов рзэ со щелочными элементами устанавливали на основании отношения Ni2+/Ln3+, после чего находили величину n/m.
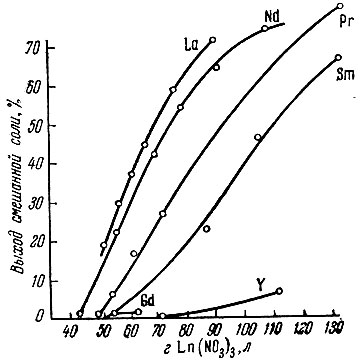
Рис. 1. Влияние концентрации Ln(NO3)3 на выход гексанитроникелатов рзэ и калия
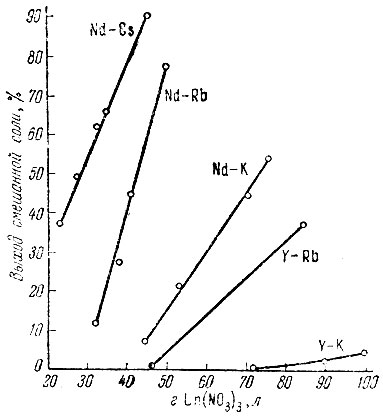
Рис. 2. Влияние концентрации Ln(NO3)3 на выход гексанитроникелатов Nd и Y с Rb, Cs и К
Выход смешанных солей зависит от концентрации компонентов в исходном растворе и отличается для различных рзэ (рис. 1). Как видно из рис. 1, при Ni2+/Ln3+ = 2 выход смешанных солей рзэ и калия увеличивается в случае возрастания концентраций исходных нитратов рзэ от 30 до 130 г/л, причем по мере уменьшения ионного радиуса элемента от лантана к гадолинию растворимость гексанитроникелатов заметно повышается. При концентрации 70 г/л Y(NO3)3 и менее смешанный гекса- нитроникелат иттрия и калия (а также следующих за ним рзэ) не выделяется. Основываясь на этом, можно достаточно четко, при помощи смешанных солей, разделять сумму рзэ на цериевую и иттриевую подгруппы, а также выделять концентраты отдельных рэз из смеси.
При получении гексанитроникелатов рзэ с Rb и Cs из их нитратов осадителем служила смесь нитратов рзэ, никеля с NaNO2 при Ni2+/Ln3+ = 2. Зависимость выхода калиевых, рубидиевых и цезиевых гексанитроникелатов Nd и Y от концентрации Ln(NO3)3 показана на рис. 2. Как видно, растворимость смешанных солей рзэ с К, Rb и Cs возрастает с уменьшением ионного радиуса рзэ; наибольшая растворимость солей наблюдается у Y. Смешанные соли Cs менее [растворимы, чем соли Rb или К. Так, например, гексанитроникелат Nd и Rb при 35 г/л Nd(NO3)3 в исходном растворе дает выход соли, равный 18%, тогда как смешанная соль Nd и Cs при этом выделяется на 67%. При той же концентрации Nd(NO3)3 в исходном растворе смешанная соль калия не осаждается. По-видимому, этим можно воспользоваться для фракционированного разделения смеси К, Rb и Cs и получения концентратов этих элементов. При различных концентрациях исходных солей, но одном и том же значении Ni2+/Ln3+ в смеси, состав гексанитроникелатов остается постоянным для любого рзэ. Ниже приведены результаты изучения состава гексанитроникелатов рзэ со щелочными элементами в зависимости от концентрации [Ni(NO2)6]4- в исходном растворе. Условия проведения опытов и обработка выделенных осадков аналогичны описанным выше.
В табл. 1 и 2 приведены результаты опытов, показывающие изменение процентного состава и величины Ni2+/Ln3+ гексанитроникелатов рзэ и калия в зависимости от заменения отношения Ni2+/Ln3+ в исходном растворе.
Из приведенных данных табл. 1 следует, что с увеличением концентрации [Ni(NO2)6]4-. B исходном растворе каждый рзэ образует ряд гексанитроникелатов с (постепенно увеличивающимся отношением n/m, что свидетельствует об увеличении количества молекул гексанитроникелата калия в молекуле смешанной соли.
Однако степень накопления молекул K4[Ni(NO2)6] в гексанитроникелатах зависит от природы рзэ, стоящего во внешней сфере комплекса.
При одинаковых концентрационных условиях более тяжелые рзэ способствуют накоплению молекул гексанитроникелата калия в осадке в большей степени, чем легкие (табл. 2). Для осаждения соли гадолиния и особенно иттрия необходимы более высокие концентрации [Ni(NO2)6]4- в исходном растворе, выделяются они значительно труднее, чем соли легких рзэ.
Зависимость изменения состава гексанитроникелатов рзэ и калия от увеличения концентрации осадителя в исходном растворе подтверждается изменением показателей преломления кристаллов, их (плотности, а также параметров кристаллической решетки, измеренных при рентгеноскопическом анализе. В табл. 3 показано, что для одного и того же рзэ показатель преломления уменьшается по мере накопления молекул K4[Ni(NO2)6] b молекуле смешанной соли.
![Таблица 1. Изменение состава смешанных гексанитроникетатов рзэ и калия в зависимости от изменения концентрации [Ni(NO2)6]4- в исходном растворе](pic/000362.jpg)
Таблица 1. Изменение состава смешанных гексанитроникетатов рзэ и калия в зависимости от изменения концентрации [Ni(NO2)6]4- в исходном растворе
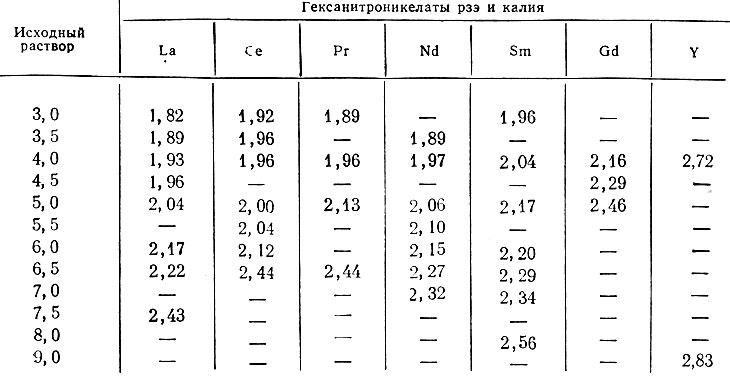
Таблица 2. Изменение величины Ni2+/La3+ в смешанных гексанитроникетатов рзэ и калия в зависимости от изменения ее в исходном растворе при содержании 0,12 г-ион Ln/л
![Таблица 3. Изменение показателя преломления кристаллов Nр смешанных гексанитроникелатов рзэ и калия в зависимости от концентрации [Ni(NO2)6]4- в исходном растворе при 20° С](pic/000364.jpg)
Таблица 3. Изменение показателя преломления кристаллов Nр смешанных гексанитроникелатов рзэ и калия в зависимости от концентрации [Ni(NO2)6]4- в исходном растворе при 20° С
Для смешанных солей рзэ показатель преломления кристаллов увеличивается в ряду от лантана к гадолинию.
Ниже приведены результаты измерения плотности кристаллов смешанных гексанитроникелатов самария и калия, из которых видно, что с увеличением отношения n/m в смешанной соли плотность кристаллов уменьшается (плотность кристаллов K4[Ni(NO2)6] × 2Н2O равна 2,153):

Рубидиевые и цезиевые гексанитроникелаты La, Nd, Sm и Y получали -аналогично калиевым смешанным солям. Величина Ni2+/Ln3+ в исходном растворе изменялась от 2 до 11 при концентрации La(NO3)3 и Nd(NO3)3 28-29 г/л, a Sm(NO3)3 - 34 г/л.
Из приведенных данных табл. 4 видно, что с увеличением концентрации осадителя в исходном растворе происходит постепенное увеличение отношения Ni2+/Ln3+ в смешанной соли. Однако для солей цезия при Ni2+/Ln3+ = 8 и выше в исходном растворе резко повышается величина Ni2+/Ln3+ в осадке. Это происходит вследствие соосаждения соли Cs3Na[Ni(NO2)6], которая благодаря меньшей растворимости получается значительно легче гексанитроникелата цезия.
Изменение состава смешанных гексанитроникелатов рзэ и рубидия (цезия) и их показатели преломления в зависимости от изменения отношения Ni2+/Ln3+ в исходном растворе
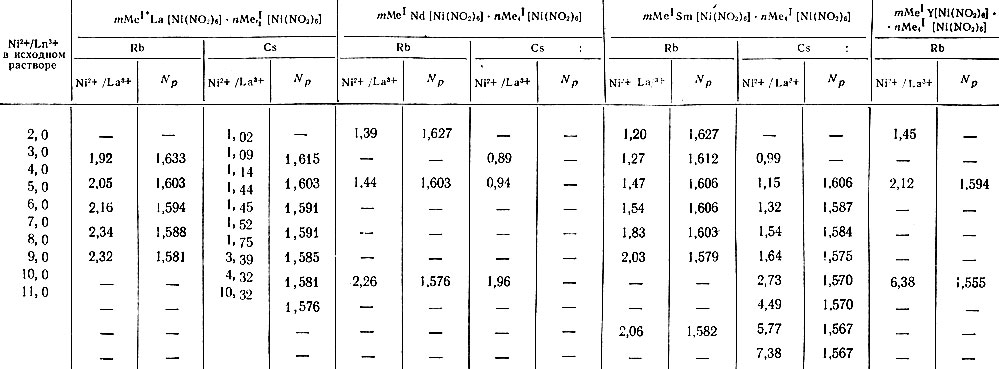
Таблица 4. Изменение состава смешанных гексанитроникелелатов рзс и рубидия (церия) и их показатели преломления в зависимости от изменения отношения Ni2+/Ln3+ в исходном растворе
* (MeI = Rb или Cs)
Соли цезия менее способны к присоединению Cs4[Ni(NO2)6], чем соли рубидия к присоединению Rb[Ni(NO2)6]; поэтому для первых, при одинаковых концентрационных условиях, величина n/m будет ниже. Это видно из рис. 3, на котором представлены гексанитроникелаты La и Nd с Rb, Cs и К. Для солей цезия (см. табл. 4)) с La, Nd и Sm были выделены соединения типа CsLn[Ni(NO2)]6, в которых величина Ni2+/Ln3+ ∼ 1, что свидетельствует об отсутствии в этих (соединениях связанных молекул гексанитроникелата цезия Cs4[Ni(NO2)6].
По мере увеличения n/m в смешанных гексанитроникелатах рзэ с Rb или Cs показатель преломления кристаллов уменьшается, поскольку сами соли Rb4[Ni(NO2)6] и Cs4[Ni(NO2)6] имеют более низкие значения показателей преломления (1,546 и 1,570, соответственно).
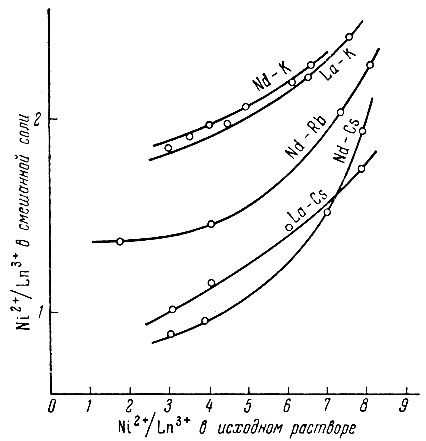
Рис. 3. Изменение состава смешанных гексанитроникелатов рзэ и К, Rb, Cs в зависимости от Ni2+/Ln3+ в исходном растворе
При осаждении смешанных гексанитроникелатов рзэ со щелочными элементами происходит изменение состава их в зависимости от продолжительности отстаивания, что видно на примере с гексанитроникелатом самария и калия (табл. 5).
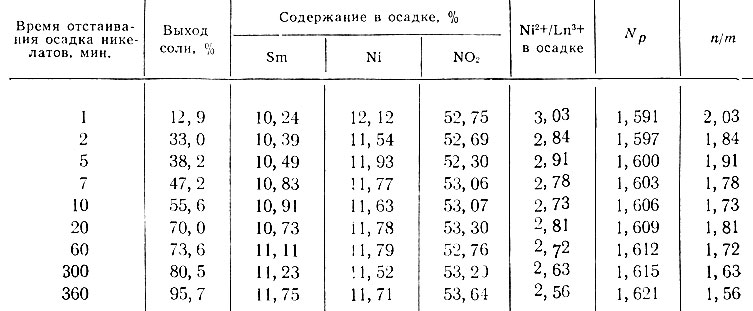
Таблица 5. Влияние времени отстаивания осадка на изменение состава смешанной соли при Ni2+/Ln3+ = 6,5
Как следует из табл. 5, при высокой начальной концентрации смеси образуется осадок смешанной соли с максимальным значением Ni2+/Ln3+. Однако с течением времени, по мере выделения гексанитроникелата в осадок, эта концентрация постепенно понижается, что приводит к образованию смешанной соли с меньшей величиной Ni2+/Ln3+.
При установлении динамического равновесия между твердой фазой и раствором состав соли остается постоянным. Изменение состава осадка смешанных солей со временем подтверждается также и показателями преломления кристаллов. Следовательно, осадок гексанитроникелатов рзэ со щелочными элементами находится в постоянном динамическом равновесии с раствором, и изменение состава последнего влечет за собой изменение состава самой смешанной соли. Таким образом, опыты показали, что в результате медленно идущей реакции между ионами Ме+, Ln+3 и [Ni(NO2)6]4- происходит постепенное изменение их концентрации в растворе, что в свою очередь приводит к изменению состава первоначально выпавшей твердой фазы во времени. Этого, так же как и влияния величины Ni2+/Ln3+ в исходном растворе, нельзя не учитывать при исследовании смешанных гексанитроникелатов рзэ.
Литература
- A. Ferrari, L. Сavаlса, М. Nardelli. Gazz. chim. ital., 81, 945 (1951).
- A. Ferrari, R. Сurti. Gazz. chim. ital., 63, 497 (1933).
- V. Cuttika, F. Gallo. Gazz. chim. ital., 53, 374 (1923).
- A. Ferrari, L. Сavalсa, M. Nardelli. Gazz. chim. ital., 81, 964 (1951).
- Г. П. Александров. Сб.: "Редкоземельные элементы". М., Изд-во АН СССР, 1958, стр. 84.
- И. В. Тананаев, М. Д. Лютая. ЖНХ, 4, 97 (1959).
- И. В. Тананаев, М. Д. Лютая. ЖНХ, 4, 457 (1959).
- A. Ferrari, L. Сavаlса, М. Nardelli. Gazz. chim. ital., 81, 982 (1951).
- Г. П. Александров, В. С. Тихонова. Укр. хим. ж., 27, 592 (1961).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'