
Изучение комплексообразования редкоземельных элементов с бензоилацетоном методом распределения (В.М. Пешкова, М.И. Громова, И.П. Ефимов)
Метод экстрагирования, основанный на изучении процесса распределения ионов металла в системе жидкость - жидкость, широко используют для определения различных физико-химических характеристик комплексных соединений [1], особенно при исследовании комплексных соединений, мало растворимых в воде, но растворимых в органических растворителях.
Теоретическое обоснование метода распределения как современного физико-химического метода исследования комплексообразования в растворах описано подробно [2-12].
При изучении процесса экстрагирования иона металла из водной фазы с определенной постоянной ионной силой в присутствии органического реагента, образующего комплексное соединение с этим ионом, исследователи исходили из возможности существования в водной фазе гипотетического комплекса состава
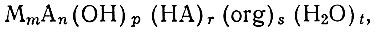
где НА - молекула органического реагента; А - лиганд; org - молекула органического растворителя.
Если предварительно установлено, что в водной фазе при определенных условиях образуются только моноядерные комплексы MAn(N-n)+ , не содержащие молекул используемого органического растворителя, то общая связь между коэффициентом распределения
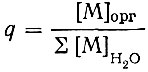
и концентрацией свободного лиганда устанавливается уравнением
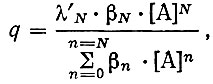
где βN - общая константа комплексообразования; [А] - концентрация свободного лиганда; N - максимальное число лигандов, способных присоединяться к данному иону металла; λ'N - константа распределения незаряженного комплекса в данной системе.
Зная зависимость lg q = f(pA), находят значения последовательных и общих констант устойчивости.
Концентрацию свободного лиганда вычисляют по уравнению [3]:
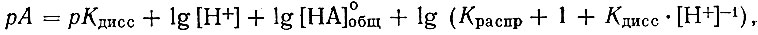
где Kдисс и Kраспр - константы диссоциации и распределения органического реагента в системе органический растворитель - вода; [Н+] - концентрация ионов водорода в водной фазе; [НА]общ0 - исходная концентрация органического реагента в органическом растворителе.
В настоящей работе метод распределения был использован для изучения комплексообразования неодима, гадолиния и эрбия с бензоилацетоном системе хлороформ - вода. Бензоилацетон образует с ионами многих металлов внутрикомплексные соединения, мало растворимые в воде, но достаточно хорошо растворимые в хлороформе, бензоле и других органических растворителях [13, 14]. Комплексообразование некоторых ионов металлов с бензоилацетоном было использовано для разделения смесей элементов [15]. Бензоилацетон образует внутрикомплексные соединения с рзэ, экстрагируемые бензолом и хлороформом. В тех же растворителях хорошо растворяется и реагент.
В работе были использованы перхлораты рзэ, приготовленные растворением спектрально чистых окисей рзэ в НCl4 (х. ч.). Концентрацию полученных растворов солей рзэ устанавливали весовым оксалатным методом. Концентрацию растворов NaOH, не содержащего СO2 и НСl4 устанавливали объемным путем. Синтезированный бензоилацетон был перекристаллизован [16] многократно из спирта (т. пл. 58° С); его чистоту контролировали также спектрофотометрически. Хлороформ и бензол очищали от примесей [17]; их чистоту контролировали рефрактометрически (для бензола nD20 = 1,5008; хлороформа nD20 = 1,4460).
Все опыты были выполнены при температуре 25 ± 0,1° С и ионной силе μ = 0,1. Для создания указанной ионной силы использовали растворы NaOH, НСl4 и NaClO4. Объемы водной и органической фаз во всех опытах были равны 15 мл (незначительной взаимной растворимостью компонентов пренебрегали). Сосуды, содержащие растворы, встряхивали в термостате в течение 5 час. (время, необходимое для установления равновесия). Равновесные фазы разделяли центрифугированием. Равновесную концентрацию бензоилацетона в водной фазе определяли спектрофотометрически по предварительно построенному калибровочному графику для щелочных растворов бензоилацетона (λ = 310 ммк). Концентрацию рзэ в водной фазе определяли спектрофотометрически с реагентом арсеназо (Nd147 определяли также радиометрически по Nd147).
Концентрации компонентов в органической фазе определяли по разности между исходной концентрацией и концентрацией их в водной фазе. Спектрофотометрические измерения выполняли на спектрофотометрах СФ-4 и СФ-5. Концентрацию ионов водорода в водной фазе контролировали при помощи лампового потенциометра ЛП-58 со стеклянным электродом.
При изучении комплексообразования методом распределения необходимо предварительное определение константы диссоциации и константы распределения в изучаемой системе применяемого органического реагента. Константа кислотной диссоциации бензоилацетона была определена спектрофотометрически с использованием метода изобестических точек [18]:
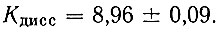
Далее было изучено распределение недиссоциированных молекул бензоилацетона между водной фазой (μ = 0,1) и хлороформом при исходных концентрациях реагента в органическом растворителе (1 × 10-1 - 1 × 10-2 мол/л) и вычислены константы распределения бензоилацетона между водной и органической фазами:
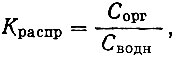
где Сорг и Сводн - равновесные концентрации реагента в органической и водной фазах.
Постоянство полученных значений констант распределения в выбранном интервале концентраций указывает на то, что в слое органического растворителя при изученных условиях не происходит ассоциации молекул органического реагента [18]:
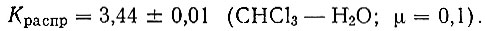
Для выяснения вопроса о существовании в изучаемой системе многоядерных комплексов или продуктов гидролиза было исследовано распределение неодима и гадолиния в системе хлороформ - вода при концентрациях рзэ в водной фазе, равных 10-4 - 10-5 г-ион/л, и постоянной концентрации бензоилацетона в хлороформе, равной 1 × 10-1 мол/л. На рис. 1 показана зависимость lg q - f(pH) для гадолиния. Совпадение кривых lg q - f(pH), полученных для различных концентраций гадолиния в водной фазе при прочих равных условиях, показывает, что в изученном интервале концентраций металла образованием многоядерных комплексов, продуктов гидролиза или полимерных частиц можно пренебречь.
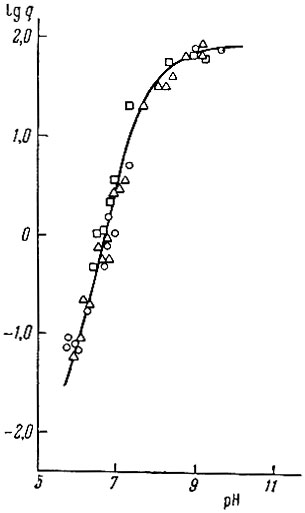
Рис. 1. Зависимость lg q от концентрации Gd3+ в водной фазе.
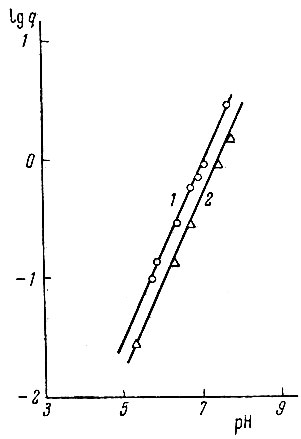
Рис. 2. Распределение Nd3+ в присутствии бензоилацетона в системах 1 - CHCl3 - H2O; 2 - C6H6 - H2O
Для выяснения возможности образования комплексных соединений, содержащих в своем составе молекулы используемых органических растворителей, приведены кривые распределения неодима в двух системах (хлороформ - вода и бензол - вода) при различных значениях pH раствора, постоянной концентрации реагента в водной фазе и других
равных условиях. Постоянство
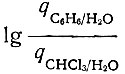
показывает, что экстрагируемый комплекс не содержит молекул органического растворителя (рис. 2).
 ">
">Рис. 3. Распределение Gd3+ в системе СНСl3 - Н2О при различных концентрациях бензоилацетона.
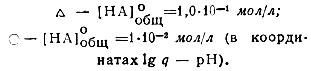
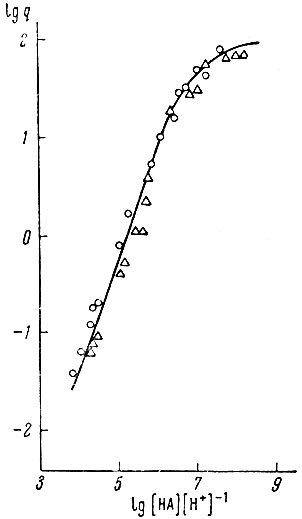
Рис. 4. Распределение Gd3+ в системе СНСl3 - Н2О при различных концентрациях бензоилацетона.
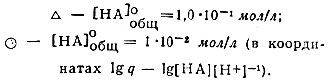
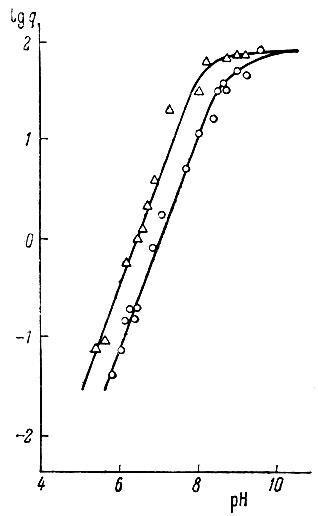
Для установления типа комплексных соединений, образующихся в водной фазе, была изучена зависимость lg q = f(pH) или lg q = flg[HA] × [Н+]-1) в системе СНС13 - вода. Ход кривых (рис. 3 и 4) для различных концентраций бензоилацетона (от 1,0 × 10-1 до 1,0 × 10-2 мол/л) отвечает теоретически предусмотренному виду для комплексов типа LnA*.
В результате изложенного выше можно считать установленным, что в выбранном интервале концентраций ионов рзэ практически образуются только моноядерные комплексные соединения LnAn(3-n)+, не содержащие в своем составе молекул органического растворителя.
Для последующего расчета [1, 14] характеристик процессов комплексообразования находят зависимость коэффициента распределения от концентрации свободных бензоилацетонат-ионов [lg q = f(рА)].
В данной работе было изучено распределение Nd, Gd и Еr в пределах указанных выше концентраций рзэ и бензоилацетона в хлороформе.
Общие кривые распределения в системе хлороформ - вода в присутствии бензоилацетона представлены на рис. 5.
Из приведенных кривых распределения были найдены вспомогательные функции Fn:
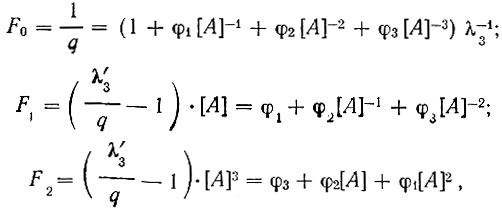
с помощью которых были рассчитаны вспомогательные φn, последовательные Кn и общие βn константы устойчивости, а также константы распределения незаряженных комплексов λ'n в системе хлороформ - вода (см. таблицу).
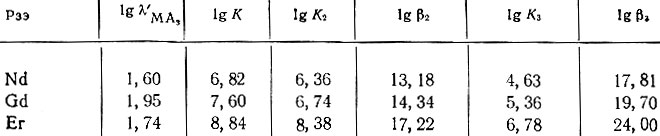
Основные характеристики процесса комплексообразования рзэ с бензоилацетоном в системе хлороформ - вода (25 ± 0,1° С; μ = 0,1)
Полученные значения констант устойчивости позволили рассчитать процентное распределение рзэ между комплексами различного состава (рис. 6).
Устойчивость комплексных соединений в растворе определяется различными факторами, в частности природой иона-комплексообразователя, а также свойствами используемого органического реагента. Чем больше заряд центрального иона и меньше его радиус, тем более стабильные комплексные соединения должны образовываться (при одинаковой электронной структуре атома). Изучение процессов комплексообразования на примере Nd, Gd и Ег с бензоилацетоном показало закономерное изменение устойчивости комплексных соединений в группе рзэ и тория [14]. Экстракция рзэ с бензоилацетоном возможна лишь в щелочной области и только при высоких исходных концентрациях бензоилацетона в хлороформе. Это определяется устойчивостью образуемых комплексных соединений.
Полученные результаты могут быть использованы при изучении органических реагентов с целью их практического применения для отделения рзэ.
Литература
- А. П. 3озуля, В. М. Пешкова. Усп. хим., 29, 234 (1960).
- J. Rydberg. Acta Chem. Scand., 4, 1503 (1950).
- J. Rydberg. Arkiv. kemi, 8, 101, 113 (1955).
- J. Rydberg. Arkiv. kemi, 5, 413, 517 (1953).
- J. Rydberg. Rec. trav. chim., 75, 737 (1956).
- H. Irving, F. I. C. Rоssоlli, R. J. P. Williams. J. Chem. Soc., 1955, 1906,
- H. Irving, F. I. C. Rоssоlli. J. Chem. Soc., 1956, 2475.
- D. Dуrssen, L. G. Sillen. Acta Chem. Scand., 7, 663 (1953).
- D. Dyrssen. Svensk kem. tidskr., 64, 213 (1952).
- D. Dyrssen. Svensk kem. tidskr., 68, 212 (1956).
- L. G. Sillen. Rec. trav. chim., 75, 705 (1956).
- L. G. Sillen. Acta Chem. Scand., 8, 299 (1954).
- И. Стары. Диссертация. МГУ, 1958.
- А. П. 3озуля. Диссертация. МГУ, 1959.
- И. Стары, Н. П. Руденко. ЖНХ, 4, 2405 (1959).
- Н. Д. Прянишников. Практикум по органической химии. М., Госхимиздат, 1956.
- А. Вайсберге р, Э. Проскауэр, Дж. Риддик, Э. Тупс. Органические растворители. М., ИЛ, 1958.
- А. П. Зозуля, Н. Н. Мезенцева, В. М. Пешкова, Ю. К. Юрьев. ЖАХ, 14, 17 (1959).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'