
Устойчивость в растворах комплексных соединений редкоземельных элементов с разнородными лигандами (Я.Д. Фридман, Р.К. Драчевская, В.А. Шестокова)
Устойчивость в растворах смешанных соединений металлов обычно уменьшается по мере увеличения различия в свойствах разнородных лигандов. Степень различия в свойствах лигандов, при которой наступает несовместимость их в одной и той же координационной сфере, зависит от природы комплексообразователя [1].
Для характеристики способности рзэ образовывать смешанные соединения представляют интерес комплексы, содержащие ионы карбоновой кислоты и галоида, а также соединения с двумя карбоновыми кислотами. Известно, что однородные галоидные соединения рзэ мало устойчивы в растворах, тогда как соединения с уксусной, винной и другими кислотами отличаюся сравнительно высокой устойчивостью.
Нами изучены равновесия в ацетатно-хлоридных растворах лантана и иттрия. Кроме того, проведено предварительное исследование взаимодействий в оксалатно-тартратных растворах иттрия.
Равновесия в ацетатно-хлоридных растворах лантана и иттрия
Для изучения равновесий рН-метрическим методом измеряли э.д.с. концентрационной цепи, в одной из ячеек которой находился раствор, содержащий 10,2 ммоля НСlO4 и 2 моля NaClO4, а в другой - ацетатный буферный раствор, к которому добавляли различные количества NaCl. Отношение концентраций уксусной кислоты и ацетата натрия в буферном растворе δ равнялось 2,027; концентрация ацетата изменялась в пределах от 40 до 150 ммолей, a NaCl - от 0 до 1,6 моля. После измерения э.д.с. ацетатной цепи (E1) в растворы вводили соль Ln(ClO4)3 и вновь измеряли э.д.с. цепи (E2). Концентрация металла в растворах колебалась в пределах 73,5-76,4 ммолей. По результатам измерений вычисляли отношение концентраций ионов водорода в растворах, содержащих и не содержащих ионы металла, по уравнению
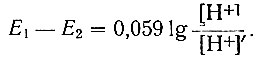 (1)
(1)В параллельных опытах определяли pH растворов, не содержащих металла. Э.д.с. цепей измеряли с хингидронными электродами на потенциометре ППТВ-1 с зеркальным гальванометром при 25° С в атмосфере азота. Постоянство ионной силы (JJ, = 2) поддерживали NaClO4.
Из рН-метрических измерений вычисляли равновесную концентрацию ионов ацетата [Ас] и функцию образования (nAc ), отвечающую среднему числу координированных ионов ацетата.
Расчеты проводили по уравнениям:
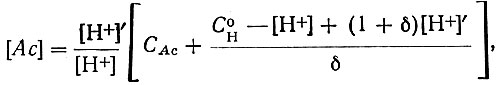 (2)
(2)где СAc - общая концентрация ацетата; С° - концентрация ионов водорода, обусловленная наличием свободной хлорной кислоты в Ln(СlO4)3;
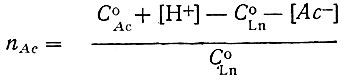 (3)
(3)(C°Ln-общая концентрация металла в растворе).
Экспериментальные данные представлены на рис. 1 и 2. Рисунки показывают зависимость функций образования, а также равновесной концентрации ацетат-ионов от концентрации ионов хлора в ацетатно-хлоридных растворах лантана и иттрия.
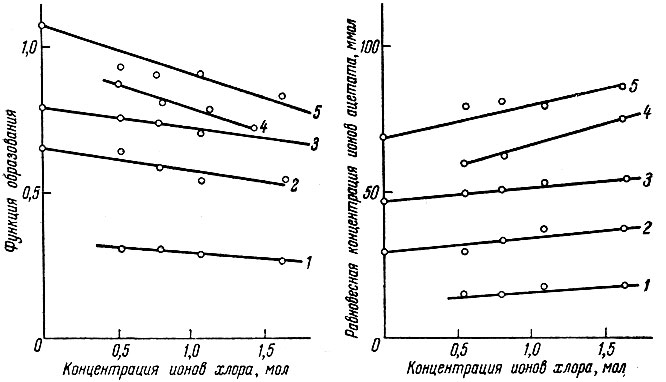
Рис. 1. Зависимость функции образования и равновесной концентрации ацетат-ионов от концентрации ионов хлора в ацетатно-хлоридных растворах лантана. Общая концентрация ацетата в растворе (в ммолях): 1 - 39,8; 2 - 79,6; 3 - 107,5; 4 - 127,4; 5 - 151,24
Из экспериментальных данных следует, что в чисто ацетатных растворах в основном существуют ионы металлов Ln3+, а также не диссоциированные частицы Ln Ас2+ и LnAc+2 . Значения функций образования находятся в пределах от 0,4 до 1,5.
Ионы хлора уменьшают величину функции образования (среднее число координированных частиц), очевидно, вследствие реакций замещения.
Реакции происходят с трудом в условиях значительного избытка ионов хлора по сравнению с концентрацией ацетат-ионов.
В связи с изложенным можно предполагать, что в ацетатно-хлоридных растворах лантана и иттрия существуют следующие равновесия:
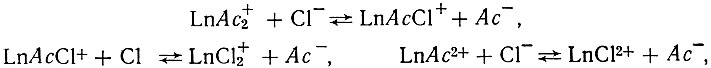
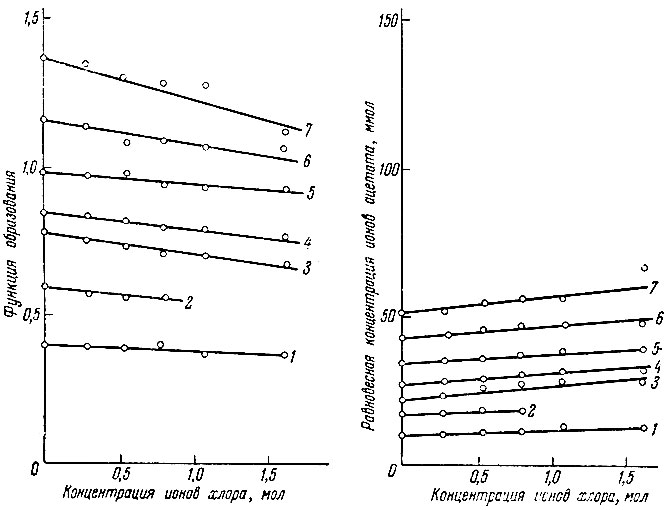
Рис. 2. Зависимость функции образования неравновесной концентрации ацетат- ионов от концентрации ионов хлора в ацетатно-хлоридных растворах иттрия. Общая концентрация ацетата (в ммолях): 1 - 39,8; 2 - 59,7; 3 - 79,6; 4 - 89,55; 5 - 107,46; 6 - 127,36; 7 - 151,24
Функция образования равняется отношению числа связанных грамм-ионов ацетата к общей концентрации металла в растворе С° :
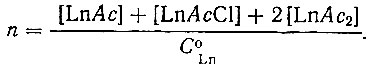 (4)
(4)Общая концентрация металла складывается из концентраций иона металла и комплексных частиц:
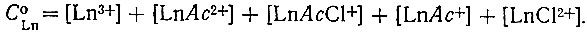 (5)
(5)Константа образования Rj, i - ацетатных комплексов определяется по закону действующих масс:
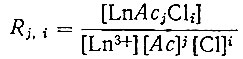 (6)
(6)Совместное решение указанных уравнений приводит к следующему выражению для функции образования:
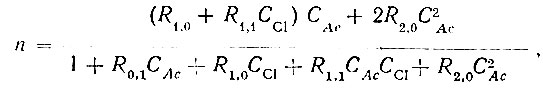 (7)
(7)где СAc и СCl - равновесные концентрации ацетат- и хлор-ионов.
На основе этого уравнения определяли константы образования отдельных соединений.
Константу образования LnAc2+(R1,0) находили как предел функции n/САс при нулевых концентрациях ацетат-ионов и ионов галоида:
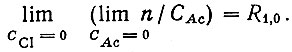 (9)
(9)Константу образования LnAc+2(R2,0) вычисляли из величины следующего предела:
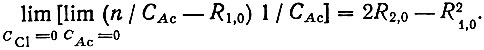 (9)
(9)Для вычисления констант образования LnCl2+ и LnAcCl+ находили пределы:
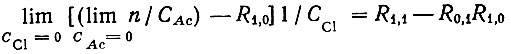 (10)
(10)и
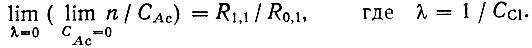 (11)
(11)Пределы определяли путем графической экстраполяции функции образования и ее производных к нулевым концентрациям ацетат-ионов при постоянной концентрации ионов хлора, а затем к нулевым концентрациям этих последних.
Найдены следующие значения констант образования комплексных частиц:

Константы образования однородных ацетатов лантана, по нашим данным, практически совпадают с данными Сунисона [2] (R1,0 = 36; R2,0 = 300 ± 30). Значения констант образования ацетатов иттрия не совпали с литературными данными. Парамонова [4] считает, что для ацетатов иттрия R1,0 = 26; R2,0 = 666, а Сунисон [3]-R1,0 = 34 и R2,0 = 459.
Однако порядок величин во всех случаях сохраняется с точностью до ±0,1 единицы показателя констант нестойкости.
На основе найденных нами констант образования комплексов вычислены константы равновесий реакций последовательного замещения ацетат-ионов на ионы хлора. Значения констант указаны в схемах над стрелками:
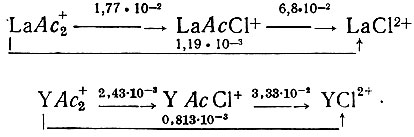
Полученные результаты приводят к выводу о том, что в ацетатно-хлоридных растворах лантана и иттрия, в условиях большого избытка ионов галоида, происходит постепенное замещение ацетат-ионов, связанных с металлами, на ионы галоида.
В промежуточных стадиях возникают смешанные соединения4 состава LnAcCl+. Ацетаты иттрия более устойчивы в растворах по сравнению с ацетатами лантана и менее подвержены действию ионов хлора.
Взаимодействия в оксалатно-тартратных растворах иттрия
К растворам оксалата аммония и винной кислоты прибавляли из микробюретки разбавленный раствор YCl3 до появления слабой стабильной мути (конус Тиндаля). Опыты проводили в термостате при 25° С и непрерывном перемешивании; исходные растворы содержали 4,67 × 10-3 и 9,34 × 10-3 мол/л YC13. Концентрация оксалата аммония изменялась в пределах от 5,28 × 10-4,до 0,3 мол/л, винной кислоты - от 0,36 до 3,21 мол/л.
Результаты измерений представлены на рис. 3.
По оси ординат отложен логарифм концентрации металла в насыщенных растворах, по оси абсцисс - логарифм концентрации оксалата аммония.
Кривая 1 относится к оксалатным растворам, остальные - к оксалат- нотартратным. Все кривые характеризуются минимумами (порог растворимости).
До точки минимума концентрация иттрия в растворах уменьшается с увеличением концентрации ионов С2О42- в соответствии с правилом произведения растворимости соли; увеличение концентрации металла за точкой минимума связано с реакциями комплексообразования.
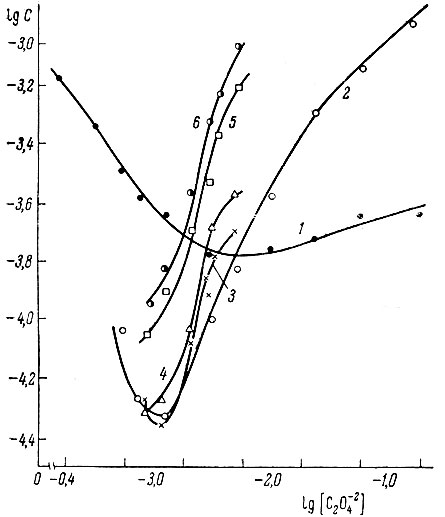
Рис. 3. Растворимость Y2(C2O4)3 в оксалатно-тартратных растворах иттрия. Концентрация винной кислоты (в моль/л): 1 - 0; 2 - 0,36; 3 - 0,5; 4 - 0,71; 5 - 1,41; 6 - 1,78
Концентрация металла в исследуемых растворах равна сумме концентраций иона металла однородных и смешанных комплексов:
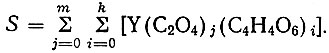 (12)
(12)Если концентрация иона металла соответствует величине произведения растворимости оксалата иттрия
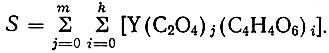 (13)
(13)то
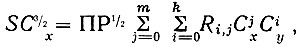 (14)
(14)где Сx и Сy - равновесные концентрации ионов С2O42- и С4Н4О62- ; Rj,i - константы образования комплексов.
На основе уравнения (14) находим, что частные производные
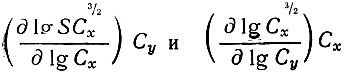
рованных ионов С2О42- и С4Н4О62-:
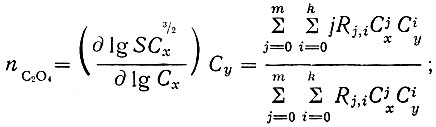 (15)
(15)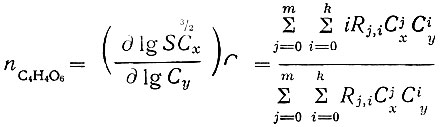 (16)
(16)Величины nC2O4 и nC4H4O6 (функции образования) практически определяли как угловые коэффициенты касательных к кривым, изображающих зависимость lgSC3/2x от lgCx и lg Сy.
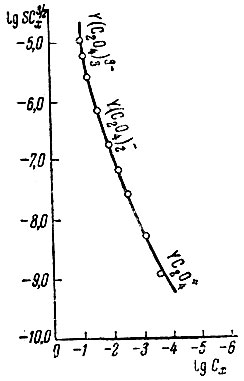
Рис. 4. Диаграмма равновесий в оксалатных растворах иттрия
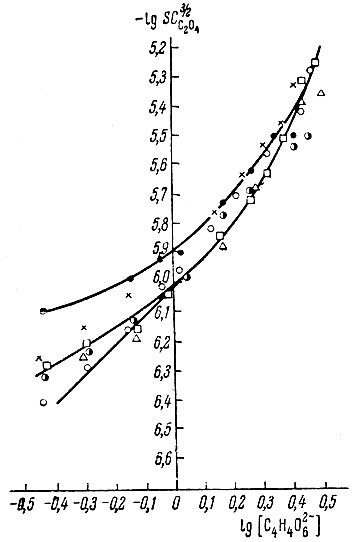
Рис. 5. Диаграмма равновесий в оксалатнотартратных растворах иттрия. Концентрация ионов С2O4 (в мол/л):
На рис. 4 показана зависимость величины lg SC3/2x от lg Сх для оксалатных растворов. Методом касательных обнаружено, что в системе существуют соединения состава YC2O+, Y(С2O4)-2, Y(C2O4)3-3. Те же соединения обнаружены [5, 6] по данным растворимости оксалата иттрия в оксалатных растворах при постоянной ионной силе (μ = 0,1).
Однако области существования комплексов, особенно YС2O4+ по литературным данным лежат при меньших концентрациях ионов С2О4 .
Расхождения, возможно, связаны с влиянием ионной силы, которая в наших опытах изменялась от 10-3 до 10-1. При ионной силе порядка 0,1, по нашим данным, существуют комплексы Y(С2O4)2- и Y(C2O4)3-3.
Константы образования этих соединений (8,22×1010 и 3,86×1011), вычисленные в предположении, что произведение растворимости Y2(С2O4)3 равно 5,34 × 10-23 [5], по порядку величин согласуются с литературными данными [5, 6].
На рис. 5 показана зависимость величины lg SC3/2x от логарифма концентрации винной кислоты для оксалатно-тартратных растворов. Каждая кривая относится к постоянной концентрации оксалата аммония. В области высоких концентраций тартрата величина lg SC3/2x практически не зависит от концентраций ионов С2О4 и приблизительно линейно возрастает с увеличением логарифма концентрации тартрата. Угловой коэффициент линейного участка равен 2.
Таким образом, в оксалатно-тартратных растворах иттрия при высоких концентрациях винной кислоты существует однородный тартрат иттрия состава Y(C4H4O6)2-. В случае уменьшения концентрации винной кислоты при постоянной концентрации оксалата аммония число координированных ионов С4Н4O6 уменьшается до одного - Y(C4H4O6)+.
При концентрациях винной кислоты до 1 М и сравнительно высоких концентрациях оксалат-ионов (5-7 × 10-2 М), по-видимому, существуют смешанные соединения. В этой области обнаруживается зависимость величины lg SC3/2x от концентраций ионов С2O4 и С4Н4O6 .
Литература
- Я. Д. Фридман. ЖНХ, 6, 1501 (1961).
- A. Sones son. Acta Chem. Scand., 12, 165 (1958).
- A. Sоnesson. Acta Chem. Scand., 14, 1495 (1960).
- В. И. Парамонова, А. С. Керейчук, Б. А. Шишляков. Радиохимия, 1, 650 (1959).
- A. M. Feibush, K. Rowley, Z. Gordon. Anal. Chem., 30, 1614 (1958).
- М. Г. Панова, В. И. Левин, H. E, Брежнева. Радиохимия, 3, 52 (1961).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'