
О составе и устойчивости комплексных глюконатов лантана, неодима и иттербия (Н.А. Костромина)
При исследовании процессов комплексообразования в системах рзэ - глюконовая кислота [1-3] было установлено, что в кислой области образуются комплексы типа LnAn, где А - одновалентный остаток глюконовой кислоты; п - число лигандов в комплексе, равное 1, 2, 3, 6.
Состав комплекса зависит от соотношения металла и глюконат-иона и от абсолютной концентрации последнего.
Для выяснения зависимости состава комплексов от условий комплексообразования использован метод ионного обмена с применением радиоактивных индикаторов. Так как в системах рзэ - глюконовая кислота в зависимости от числа лигандов возможно образование катионных, электронейтральных и анионных комплексов, для исследования был применен метод Парамоновой [4], предусматривающий изучение поглощения из одного и того же раствора на катионите и анионите.
Исследование проводили на катионите КУ-2 и анионите АН-1 с радиоактивными изотопами La140, Nd147 и Yb175 для растворов с постоянной ионной силой при pH 2-3. Растворы содержали 10-7 мол/л радиоактивного изотопа рзэ и различные концентрации глюконовой кислоты (от 0,5-10-2 до 1 1 × 10-1 мол/л).
При добавлении глюконовой кислоты поглощение рзэ катионитом уменьшается. Зависимость поглощения La, Nd и Yb катионитом от концентрации глюконат-иона показана на рис. 1. Уменьшение поглощения рзэ катионитом можно объяснить образованием положительных или отрицательных комплексных ионов или электронейтрального комплекса.
При таких же концентрациях глюконат-иона рзэ поглощаются анионитом (рис. 2), причем поглощение увеличивается с повышением концентрации глюконата. Это можно объяснить образованием в системе комплексов с отрицательным зарядом, количество которых возрастает с увеличением концентрации глюконата. Сравнение поглощения рзэ при одинаковой концентрации глюконата показывает, что от лантана к иттербию поглощение катионитом уменьшается, а анионитом возрастает. Такое изменение поглощения рзэ указывает на увеличение прочности комплексов в этом ряду.
Анионные комплексы, наличие которых доказано поглощением рзэ анионитом, должны содержать не менее четырех одновалентных остатков глюконовой кислоты. В изученной системе возможно также образование катионных и электронейтральных комплексов, содержащих один, два и три глюконат-иона [1-3]. Обнаружить такие комплексы можно при сопоставлении относительного поглощения на катионите (γ+) и анионите (γ-), выражающего относительные количества свободного металла (а также, частично, комплексных катионов) и комплексных анионов [4]. На рис. 3 показано относительное поглощение La, Nd и Yb катионитом и анионитом. Как видно, сумма катионных и анионных форм в системах рзэ - глюконовая кислота меньше 1, т. е. в системе образуются комплексы, которые не поглощаются ионитами. Число этих комплексов ограничено кривыми γ+ и γ-. Относительное содержание анионных комплексов в пределах изученных концентраций глюконата для лантана и неодима не превышает 10%, для иттербия достигает 90%.
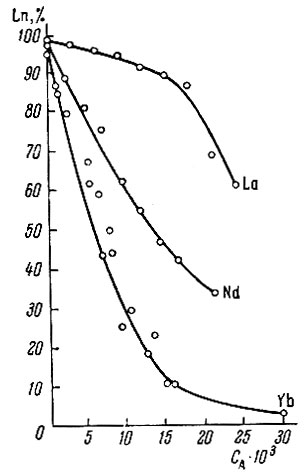
Рис. 1. Поглощение La, Nd и Yb катионитом в зависимости от концентрации глюконат-иона
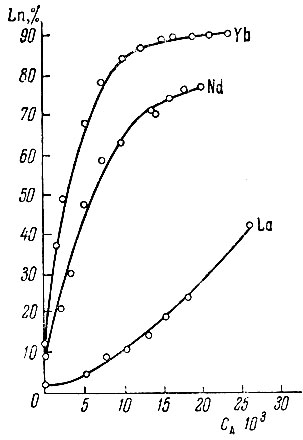
Рис. 2. Поглощение La, Nd и Yb анионитом в зависимости от концентрации глюконат-иона
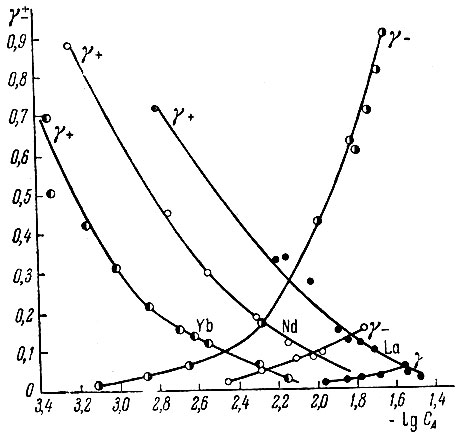
Рис. 3. Относительное поглощение La, Nd и Yb катионитом и анионитом в зависимости от концентрации глюконат-иона
Комплексами, которые не поглощаются ионитами, могут быть электронейтральный LnA03 и катионные LnA2+ и LnA+2 которые в присутствии свободного металла поглощаются не полностью.
Константы нестойкости комплексов, содержащих от одного до трех глюконат-ионов, рассчитывали по данным катионного обмена методом Фронеуса [5]; при этом учитывали наличие трех комплексов в системе и частичное поглощение комплекса LnA2+ катионитом. В случае иттербия константы рассчитывали при концентрациях глюконата, когда относительное количество анионных форм не превышает 10%.
Для расчета использовали экспериментально полученные коэффициенты распределения в отсутствие (Кd0) и присутствии (Кd) глюконат-иона:
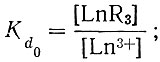 (1)
(1)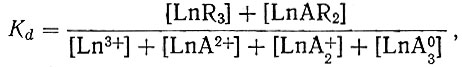 (2)
(2)где [LnR3] и [LnAR2] - концентрации металла и комплексного катиона в катионите; [Ln3+], [LnA2+], [LnA+2] и [LnA03] - концентрации металла и комплексных ионов в растворе.
Вычисленные значения констант нестойкости
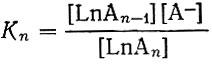
приведены в таблице.
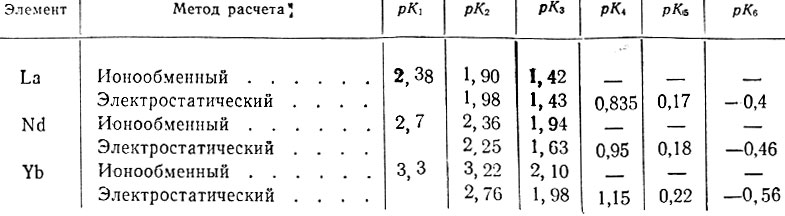
Величины рКn для комплексов LnAn (Ln = La, Nd, Yb)
Полученные по данным ионного обмена константы нестойкости комплекса LnA2+ для La и Nd совпадают, а для Yb несколько отличаются от значений, установленных ранее потенциометрическим методом (рК = 2,7 ±0,1) [6].
Проведенный расчет показал, что комплекс LnA2+ в условиях эксперимента поглощается на 60-80% катионитом.
Константы нестойкости анионных комплексов были рассчитаны из константы нестойкости комплекса LnA2+ и соотношений между последовательными константами нестойкости в ряду LnAn. При этом исходили из предположения, что в системе образуются комплексы, содержащие от одного до шести лигандов.
Соотношения между последовательными константами нестойкости находили из электростатических характеристик методом Ходакова [7]. Проверкой правильности такого расчета служило сопоставление констант нестойкости комплексов LnA2 и LnA03, полученных экспериментальным и расчетным путем.
Найденные этим методом величины рКn комплексов LnAn (n = 2-6) приведены также в таблице.
Из таблицы следует, что величины констант нестойкости комплексов LaA2+ и LаА03, полученные по данным ионного обмена и вычисленные из электростатических характеристик, совпадают. Следовательно, в системе с лантаном преобладающее взаимодействие электростатическое, и проведенный расчет констант правильный.
В системах с неодимом и иттербием вычисленные значения рK2 и рК3 меньше найденных из данных ионного обмена, что связано, по-видимому, с поляризационным взаимодействием. Различия в величинах констант невелики. Поэтому рассчитанные значения рК4, рК5, рК6 можно применять как условные для приближенной характеристики прочности комплексов.
Сопоставление констант нестойкости комплексов La, Nd и Yb показывает, что прочность комплексов увеличивается от лантана к иттербию, причем наиболее резко увеличивается прочность комплекса, содержащего два глюконат-иона на атом металла. Прочность комплексов, содержащих четыре, пять и шесть глюконат-ионов, невелика. Константа нестойкости комплекса МА3-6 больше единицы, следовательно, такой комплекс может существовать в растворе только при очень большом избытке лиганда.
Для установления области существования комплексов в зависимости от концентрации глюконата были рассчитаны относительные содержания комплексов La, Nd и Yb (АN) при концентрациях глюконата от 2 × 10-4 до 5 × 10-1 г-ион/л по формуле
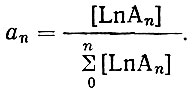 (4)
(4)Полученные для лантана данные приведены на рис. 4. На этом же рисунке пунктиром показано относительное поглощение лантана анионитом при концентрациях глюконата от 1 × 10-2 до 2,5 × 10-2 г-ион/л. Из рис. 4 следует, что поглощение лантана анионитом в условиях, в которых изучали ионный обмен, обусловливается образованием комплекса LaA4.
Комплексы LaA52- и LaA63- образуются при более высоких концентрациях глюконата.
Относительные содержания комплексов неодима и иттербия в зависимости от концентрации глюконата приведены на рис. 5 и 6. В этих системах относительное поглощение на анионите (пунктир) больше вычисленного содержания анионных комплексов, что может быть связано с заниженными значениями констант, при расчете которых не учитывали поляризационного взаимодействия в системах неодима и иттербия.
Для выражения зависимости состава комплексов от концентрации глюконата и соотношения компонентов удобно применять диаграммы комплексообразован,ия, устанавливающие поля доминирования комплексов в системах. Эти диаграммы можно построить при наличии данных о прочности комплексов [7].
На рис. 7 приведена диаграмма равновесий комплексообразования для системы Ln3+-А-Н2O, где Ln = La, Nd, Yb.
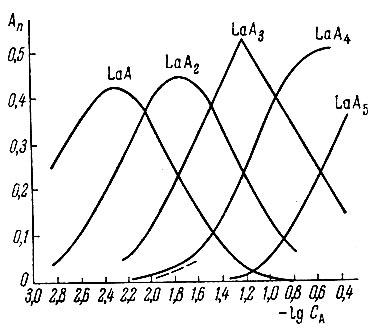
Рис. 4 Распределение La между комплексными ионами LaAn.
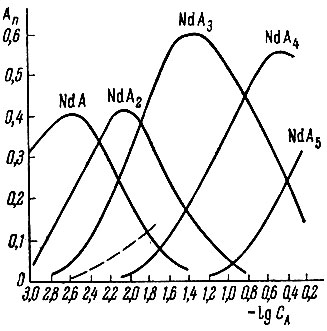
Рис. 5. Распределение Nd между комплексными ионами NdAn
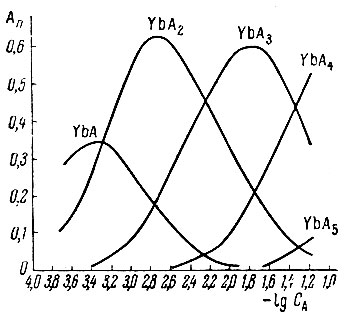
Рис. 6. Распределение Yb между комплексными ионами YbAn
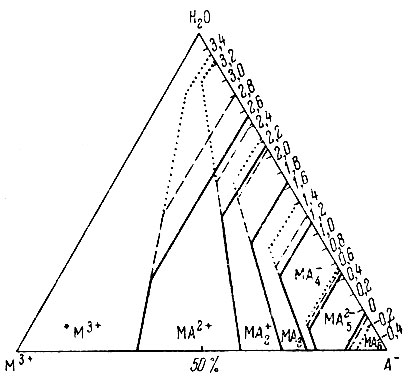
Рис. 7. Поля доминирования отдельных комплексов в системе Ln3+ - А- - Н2О (Ln = La, Nd, Yb)
Из диаграммы следует, что комплексы LnA5 могут образовываться только при концентрациях глюконата выше 0,84 г-ион/л, комплексы LnA63- - при концентрациях выше 3 г-ион/л. В этих случаях для образования комплексов требуется большой избыток глюконата, по сравнению со стехиометрическими соотношениями. Эти выводы согласуются с экспериментальными данными, полученными ранее [1-3]. Комплексы Na3[LnA6] для лантана и неодима были выделены спиртом из 5 М растворов глюконата натрия при отношении LnCl3 к глюконату натрия 1:20.
Литература
- Я. А. Фиалков, Н. А. Костромина. ЖНХ, 4, 1507 (1959).
- Н. А. Костромина. ЖНХ, 5, 97 (1960).
- Н. А. Костромина. Укр. хим. ж., 26, 3 (1960).
- В. И. Парамонова. ЖНХ, 2, 523 (1957).
- S. Fronaeus. Acta Chem. Scand., 5, 859 (1951); 6, 1200 (1952).
- H. А. Костромина. Укр. хим. ж., 26, 299 (1960).
- А. К. Бабко. Физико-химический анализ комплексных соединений в растворах. Киев, Изд-во АН УССР, 1955, стр. 33.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'