
Исследование комплексных соединений редкоземельных элементов с гексаметилендиаминтетрауксусной кислотой (А.А. Кузьменко)
Вопрос взаимодействия гектаметилендиаминтетдауксусной кислоты* с различными металлами в литературе мало освещен.
* (Впервые синтезирована Ластовским с сотрудниками [1].)
Сведения о комплексных соединениях рзэ с Н4ГМ* [2] ограничиваются предварительным полярографическим определением сдвига потенциалов полуволн рзэ. Полученные результаты свидетельствуют о различной прочности образуемых комплексов.
* (Гексаметилендиаминтетрауксусная кислота в тексте обозначается сокращен но - Н4ГМ)
Измерения удельной электропроводнэсти и pH водных растворов систем, содержащих хлориды La, Се, Nd, Y и натриевые соли Н4ГМ, по методу непрерывных изменений показали, что максимум отклонения от аддитивности (Ах), резкий скачок потенциала pH и максимум образования осадков в системах соответствуют молярному отношению рзэ : Н4ГМ = 1 :0,75 и 1 : 1[3].
Частичное растворение осадков при потенциометрическом титровании щелочью смесей рзэ - Н4ГМ и несимметричность изотерм электропроводности указывают на образование в системе больше одного комплексного соединения.
Потенциометрическое рН-титрование смесей, содержащих хлорид Ln3+ и Н4ГМ, также подтверждает наличие взаимодействия между компонентами (кривые титрования смесей расположены ниже кривых титрования комплексона) [3].
Кривые рН-титрования смеси, соответствующие молярному отношению Ln3+ : Н4ГМ = 1 : 0,75 и 1 : 1, в кислых растворах мало отличаются от кривых титрования самого комплексона. Заметное различие проявляется лишь начиная с pH 5 и выше (область pH, соответствующая 2 экв. щелочи на 1 моль комплексона) [3].
При pH 6 и выше на кривых рН-титрования намечается буферная область и выделяются осадки (в области pH, соответствующей 2-3 экв. щелочи на моль комплексона), количество которых зависит от pH раствора, молярного отношения компонентов, порядкового номера элемента и растворимости образующихся соединений.
Потенциометрические кривые можно разделить на три области:
- pH 4-5,5 соответствует 1-2 экв. щелочи на моль комплексона. Ни в одной из исследованных систем, содержащих хлориды рзэ и комплексон при молярных отношениях Ln3+: Н4ГМ = 1 : 0,75; 1 : 1 и 1 :2, осадки не образуются.
- pH 6-7,1 соответствует 2-3 экв. щелочи на моль комплексона. В этой области при отношении 1 : 0,75 - появляются мелкокристаллические осадки, при 1:1 - коллоидные.
- pH 7,3-9,6 соответствует 3 экв. щелочи и выше; наблюдается постепенное растворение осадков: для элементов цериевой подгруппы медленное, иттриевой - более быстрое, в зависимости от pH раствора и избытка комплексона.
Ниже приведены результаты изучения различий в поведении водных растворов комплексных соединений, образованных Ln3+ и Н4ГМ, в зависимости от pH раствора, молярного отношения компонентов системы и порядкового номера элемента, а также количественного определения степени осаждения рзэ из растворов в присутствии комплексона.
Катионные комплексы
При pH 4-5,5 существуют, очевидно, малоустойчивые катионные комплексы, находящиеся в равновесии с простыми гидратированными ионами Ln3+. Выделить их в индивидуальном состоянии не удалось. При добавлении к раствору (pH 3,5) спирта выделяется комплексная кислота состава Н4ГМ. Однако есть данные, подтверждающие наличие катионных комплексов в растворе.
Методы измерения удельной электропроводности и pH изомолярных растворов при суммарной концентрации 0,005 М указывают на слабое взаимодействие между Nd3+ (или Y3+) и Н4ГМ при pH 4,2 (величина 4-Δχ составляет 18-20% от суммарной концентрации, а pH понижается на 0,3 единицы).
При титровании 0,0025 М (pH 5,1) раствора СеС13 раствором Н4ГМ (pH 5,2) pH смеси понижается на 0,4 единицы.
Знак заряда комплексных ионов La, Dy, Y, Но, Ег, Yb с Н4ГМ (при отношении Ln3+:H4ГM= 1:2 и pH 5,5) .определяли путем изучения переноса металла при электролизе растворов; в результате показано, что металл переносится в катодное пространство.
Как видно из табл. 1, степень сорбции ионов рзэ из растворов систем рзэ - комплексон уменьшается от лантана к иттербию и зависит от молярного отношения компонентов.
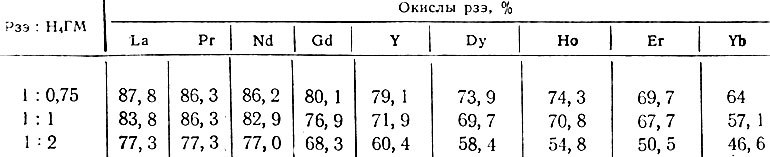
Таблица 1. Степень сорбции ионов рзэ катионитом КУ-2 в натриевой форме из растворов комплексона при pH 5,5*
* (Определения проводили в статических условиях. К 1.0 г катионита КУ12 приливали равные объемы исследуемых растворов, имеющих одинаковую исходную концентрацию элемента (0,0025 М). но разное содержание комплексона. Содержание металла в растворе определяли оксалатным методом [4].)
Из приведенных данных видно, что при pH 5,5 степень сорбции элементов цериевой группы составляет в среднем приблизительно 70-80%, иттриевой - 65-50%, что указывает на присутствие в растворе при данных условиях катионных форм комплексов.
При pH 5,9-7,1 в системах рзэ - Н4ГМ образуются осадки комплексных соединений состава HLnC14H20N2O8 и Ln4(C14H20N2O8)3. Кривые нагревания комплексов, снятые на регистрирующем пирометре Курнакова, указывают на то, что все выделенные комплексные соединения не содержат кристаллизационной воды и характеризуются различной термической устойчивостью*.
* (Изучение свойств указанных комплексов продолжается)
При pH 7,3 наблюдается медленное растворение осадков в щелочи и избытке Na4ГM.
Элементы иттриевой подгруппы обладают значительно большей растворимостью. При наличии в растворе избытка Na4ГM осадки комплексных соединений не образуются.
Определение заряда комплексных ионов при электролизе растворов, содержащих хлориды La, Dy, Y, Но, Ег, Yb и комплексон (pH 9,6; отношение Ln3+ : Н4ГМ =1:2), показало, что металл переносится в анодное пространство.
Исследование сорбции указанных металлов катионитом КУ-2 при pH 9,6 не дало хороших результатов, так как при этих значениях pH растворы комплексных соединений некоторых рзэ склонны образовывать, студни.
Степень осаждения рзэ из растворов в присутствии комплексона
Для определения различий в поведении отдельных рзэ в присутствие комплексона было проведено количественное определение степени осаждения рзэ из растворов, содержащих разные количества комплексона. Готовили растворы с одинаковым содержанием хлорида рзэ и разным количеством Na4ГM (pH 10,5)*. Спустя час после смешивания растворов выделившиеся осадки фильтровали и прокаливали. Оставшиеся в фильтрате рзэ осаждали оксалатом натрия. Однако часть металла все же не осаждалась и выделялась из фильтрата лишь после понижения pH до 3-2.
* (При сливании растворов pH понижалось до 6,3-7,1 в зависимости от природы соответствующих солей.)
Результаты осаждения рзэ из растворов в присутствии комплексона приведены в табл. 2. В зависимости от количества выделенного осадка рзэ можно разделить на три группы.

Таблица 2. Осаждение рзэ из водных растворов комплексона
* (Около 95% Y остается в растворе.)
Как видно, с увеличением молярного отношения компонентов от 1 :0,75 до 1 : 1 повышается процент осаждения рзэ из раствора. Дальнейшее увеличение отношения до 1 : 2 и выше сопровождается уменьшением, а затем полным растворением осадков рзэ иттриевой и цериевой подгрупп.
Результаты изучения рзэ с гексаметилентетрауксусной кислотой показывают, что состав и свойства растворов зависят от pH и молярного отношения компонентов. В слабокислых растворах (pH 4-5) взаимодействие между компонентами проявляется слабо. Металлы в растворах находятся преимущественно в виде катионных форм. Увеличение pH раствора до 7,3 и выше сопровождается образованием осадков комплексных соединений типа НLnС14Н20N2O8 и Ln4(C14H20N2O8)3, частично растворяющихся в щелочи. При наличии в растворе избытка комплексона осадки растворяются полностью с образованием анионных комплексов. Степень осаждения рзэ из растворов в присутствии комплексона уменьшается от лантана к иттербию. Элементы иттриевой подгруппы осаждаются на 20-30% (значительное количество иттрия удерживается в растворе). Такое различие в свойствах рзэ цериевой и иттриевой подгрупп может быть использовано для их разделения.
Литература
- Р. Ластовский, В. Вайнштейн, Н. Дятлова, В. Темкина, И. Колпакова. Ж АХ, 10, 128 (1955).
- В. Темкина, Р. Ластовский, Н. Дятлова, Сборник научной информации" ИРЕА, вып. 3-5. М., 1960, стр. 26.
- А. Кузьменко. ЖНХ, 3, 1829 (1958).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'