
Комплексообразование лантана с винной кислотой (Н.К. Давиденко)
Из виннокислых соединений лантана известен лишь средний тартрат. Он выделяется в виде белого аморфного осадка при сливании растворов солей лантана и винной кислоты или виннокислых солей щелочных металлов. При нагревании под маточным раствором он переходит в кристаллическое состояние, образуя, кристаллогидрат Lа2(С4Н4O6)3 ÷ 9Н2O [1]. Тартрат лантана малорастворим в воде [2], но легко растворяется в растворах кислот, щелочей и тартратов щелочных металлов. Состав и свойства образующихся при этом соединений не установлены.
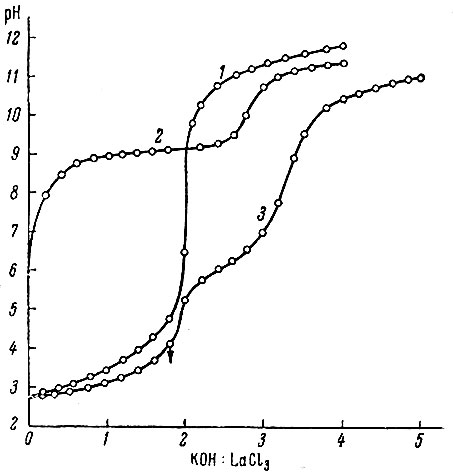
Рис. 1. Потенциометрическое рН-титрование щелочью LaCl3, винной кислоты и их эквимолярной смеси. 1 - Н2Таr; 2 - LaCl3; 3 - LaCl3: H2Tar = 1 : 1
В настоящей работе изучено взаимодействие ионов лантана и винной кислоты при их различных соотношениях и в зависимости от концентрации водородных ионов. В работе использованы методы потенциометрического рН-титрования, растворимости и препаративный метод.
На рис. 1 приведены кривые потенциометрического рН-титрования щелочью 2,5 × 10-3 М растворов винной кислоты, LaCl3 и их эквимолярной смеси. Кривая титрования смеси лежит ниже кривой титрования кислоты, что указывает на комплексообразование. Нижний буферный район соответствует нейтрализации двух ионов водорода, а скачок на кривой - выделению осадка тартрата лантана. Если продолжать титрование, то на кривой в нейтральной области появляется буферная площадка, соответствующая добавлению третьего эквивалента щелочи, а затем наблюдается плавный подъем.
Изменение относительного количества винной кислоты в смеси почти не меняет положения первого скачка на кривой титрования - во всех случаях он соответствует добавлению двух эквивалентов щелочи на один моль кислоты.
К сожалению, данные потенциометрического титрования нельзя было использовать для расчета констант нестойкости виннокислых комплексов лантана, так как даже растворы, выдержанные в течение десяти дней, не равновесны: при длительном хранении из них постепенно выделяются осадки.
Для расчета состава и устойчивости виннокислых комплексных соединений лантана был использован метод растворимости.
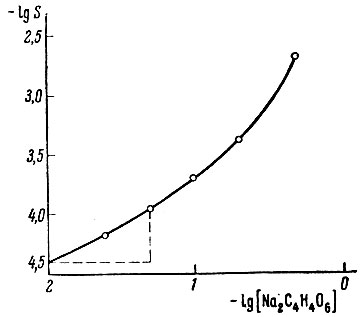
Рис. 2. Растворимость тартрата лантана в 0,01 - 0,5 М раствора тартрата натрия
Растворимость определяли в термостатированных сосудах, снабженных механическими мешалками. После установления равновесия в насыщенных растворах определяли лантан колориметрическим методом с алюминоном [3]. Пробу предварительно освобождали от органических веществ обработкой концентрированной HNO3.
На рис. 2 приведена логарифмическая кривая растворимости тартрата лантана в 0,01-0,5 М растворах тартрата натрия при 25° С. С увеличением концентрации тартрата натрия растворимость возрастает, что указывает на комплексообразование. В области концентраций 0,01-0,05 М растворение не сопровождается изменением pH раствора (незначительное повышение pH - порядка 0,1 для наиболее низких концентраций - может быть отнесено за счет частичного гидролиза тартрат-иона). Наклон кривой растворимости в этой области равен половине, что соответствует реакции
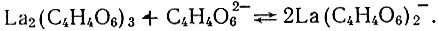 (1)
(1)Растворение в более концентрированных растворах тартрата натрия сопровождается понижением pH. Это может быть объяснено участием в комплексообразовании спиртовых групп тартрат-иона:
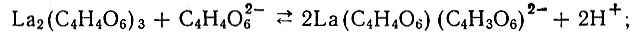 (2)
(2)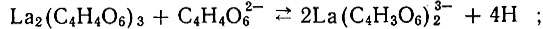 (3)
(3)или гидролизом комплексного иона:
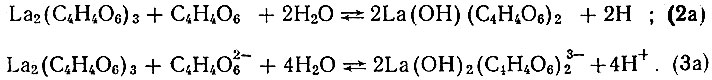
Следовательно, для определения состава и устойчивости комплексов, образуемых в растворе ионами La3+ и тартрата, можно использовать данные о растворимости тартрата лантана в растворах тартрата натрия с концентрацией ≤ 0,05 М.
На рис. 3 показана растворимость тартрата лантана в буферных виннокислых растворах при суммарной концентрации тартрата 0,05 М, pH растворов изменялось в пределах 2,15-6,83. На оси абсцисс отложены концентрации тартрат-иона, которые рассчитывали по формуле
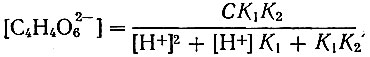 (4)
(4)где С - суммарная концентрация тартрата; K1 и K2 - константы диссоциации винной кислоты.
На оси ординат отложены значения растворимости.
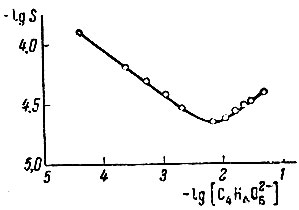
Рис. 3. Растворимость тартрата лантана в буферных виннокислых растворах
Если при растворении тартрата образуется LaTar+, то наклон кривой должен быть равен 1/2; при образовании LaTar-2-+1/2, a LaTar3-3-+3/2. Полученная кривая растворимости имеет две ветви: нисходящую с наклоном
- 2/5 и восходящую с наклоном + 1/3. Нисходящая ветвь кривой связана с подавлением диссоциации тартрата лантана и выделением некоторой его растворах, части в осадок. Восходящая ветвь кривой связана с растворением тартрата лантана и образованием LaTar2 .
На основании наклона кривой можно сделать вывод, что в растворе существуют равновесия:
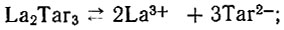 (5)
(5)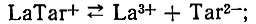 (6)
(6)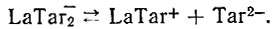 (7)
(7)Эти равновесия определяются постоянными:
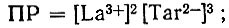 (5а)
(5а)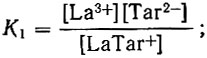 (6а)
(6а)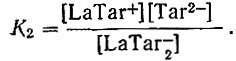 (7а)
(7а)Растворимость в каждой точке кривой равна:
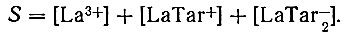 (8)
(8)Подставив в это уравнение значения концентраций ионов, выраженные через постоянные ПР, К1, К2, и концентрацию тартрат-иона, получаем уравнение с тремя неизвестными (ПР, K1 и К2)- Для удобства в вычислениях введем обозначение
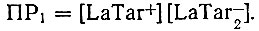
Постоянная ПР1 связана с другими величинами зависимостью:
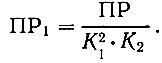
Уравнение (8) можно записать в виде:
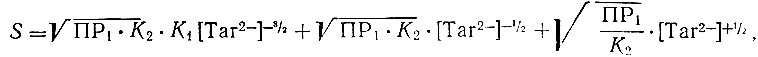 (9)
(9)так как
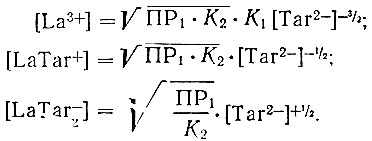
Подставляя в уравнение (9) экспериментально определенные значения растворимости при различных концентрациях тартрат-иона и решая систему уравнений относительно ПР1, К1 и K2, получаем их значения и вычисляем ПР тартрата лантана.
Вычисленные значения равны: К1 = 4,4×10-3, К2 = 4,1×10-2, ПР = 4,2×10-16.
На рис. 4 показаны кривые потенциометрического рН-титрования смесей LaCl3 и тартрата калия при отношениях 1:1, 1 : 5 и 1 : 50. Для сравнения приведена также кривая титрования одного LaCl3. Концентрация LaCl3 во всех растворах одинакова (2,5 10-3).
В присутствии тартрата натрия процесс гидролиза (или диссоциация ионов водорода ОН-групп, связанных в комплекс ионов тартрата) происходит при значительно более низких pH. До pH 9 во всех случаях поглощается 1,5 экв. КОН на 1 моль LaCl3. При отношении компонентов 1: 1 осадок остается до конца титрования (pH 11); при отношении 1:5 осадок тартрата лантана растворяется после добавления 1,2 экв. КОН (pH 7,6); при отношении 1 : 50 - растворяется после добавления первых же капель КОН (pH 7,02). Таким образом, избыток тартрата и повышение pH способствуют образованию растворимых виннокислых соединений лантана.
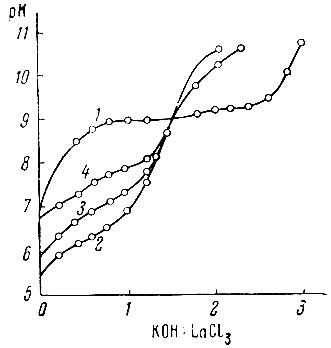
Рис. 4. Потенциометрическое рН-титрования смесей LaCl3 и тартрата калия при отношениях 1 : 1 (2), 1 : 5 (3) и 1 : 50 (4)
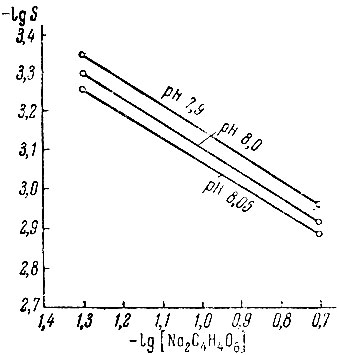
Рис. 5. Растворимость тартрата лантана в щелочных растворах тартрата натрия
Для определения их состава была изучена растворимость тартрата лантана в щелочных 0,05 и 0,2 М растворах тартрата натрия. Результаты приведены в табл. 1.

Таблица 1. Растворимость тартрата лантана в щелочных растворах тартрата натрия
Как видно, растворимость тартрата лантана в щелочных растворах Na2C4H4O6 значительно выше, чем в нейтральных и кислых растворах последнего, и зависит от pH исходного раствора. Для определения состава соединения интерполяцией найдена растворимость при одинаковых значениях pH и нанесена на график -lg S - - lg[Na2C4H4O6]. Получены прямые, наклон которых ∼2/3, что указывает на преимущественное образование соединения с соотношением металл : лиганд = 1:2 (рис. 5).
Данные потенциометрического титрования смесей с избытком тартрата (см. рис. 4) указывают на то, что в области, близкой к нейтральной, поглощается один ион гидроксила, при более высоких pH - второй.
Следовательно, в щелочных [растворах, содержащих избыток ионов тартрата, можно предположить образование комплексных анионов La(C4H4O6)(C4H3O6)2- и La(C4H3O6)3-2 (или La (ОН) (С4Н4O6)2-2 и Lа(OН)2(С4Н4O6)3-2).
Константы равновесия реакций образования этих соединений, вычисленные по данным растворимости, равны:
В отсутствие избытка тартрата (при отношении La : тартрат = 1 : 0,5) в сильнощелочной среде возможно образование растворимого гидроксикомплекса La2(OH)2(C4H2O6) (Н2O)6 [4].
Для выделения виннокислых соединений лантана были смешаны растворы LaCl3, винной кислоты и NaOH в различных соотношениях. Полученные осадки после промывания водой, спиртом и и эфиром высушивали при 100° С и анализировали. Условия выделения осадков, результаты анализа последних и предполагаемый состав приведены в табл. 2. Если при смешивании растворов осадки не выделялись, добавляли примерно 50 об.% спирта.
Теоретическая потеря веса при прокаливании La2(C4H4O6)3 равна 54,8%, LaC4H3O6×H20 - 46,2%, NaLaC4H2O6×Н2O - 33,6%.
В последней графе табл. 2 в скобках указана предполагаемая примесь к основной соли.
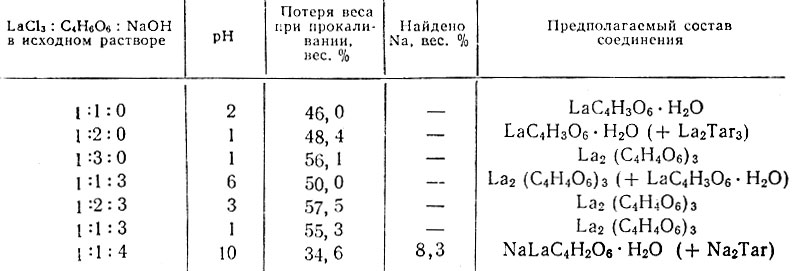
Таблица 2. Выделение виннокислых соединений лантана
На основе полученных данных взаимодействие лантана с винной кислотой в зависимости от pH и избытка винной кислоты можно представить следующей схемой:

B сильнощелочных растворах следует предположить существование непрочных катионов с ионом битартрата: La(C4H2O6)2+ и La(C4H5O6)2. Более устойчиво, вероятно, электронейтральное соединение La(C4H5O6) × (С4Н4O6). Это кислый тартрат, выделенный в кристаллическом виде для церия и некоторых других рзэ из сильнокислых растворов, содержащих избыток винной кислоты [5]. Существование в растворах ионов La(C4H4O6)+ H La(C4H4O6)- доказано нами методом растворимости. Соединение LaC4H3O6×H2O или La(0H)C4H4O6 выделено из раствора при pH 2, содержавшего эквимолярную смесь LaCl3 и винной кислоты. Наименее растворим в системе средний тартрат лантана - La2(C4H4O6)3. Он выделяется из растворов в широком интервале pH и соотношений компонентов. Существование в слабощелочных растворах при избытке тартрата Lа(С4Н3O6)2- (С4Н4O6)2- и Lа(С4Н3O6)23- (или La (ОН) (С4Н4O6)2-2 и La(OH)2(C4H4O6)3-2) установлено на основании данных потенциометрического титрования и растворимости.
Литература
- О. Holm berg. Z. anorg. Chem., 53, 86 (1907).
- E. Rimbach, A. Schubert. Z. phvs. Chem.. 67, 183 (1909).
- L. Hoi leek, D. Eckardt, L. Hartinger. Z. anal. Chem., 146, 103 (1955).
- К. Л. Маляров, Ф. М. Судаков. ЖНХ, 6, 1559 (1961).
- L. Lor tie. Ann. Chim. 14, 407 (1930).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'