
Комплексные цитраты церия (В.Г. Сильниченко)
Комплексообразование рзэ, впервые наиболее отчетливо показанное Рябчиковым и Терентьевой [1, 2], в последнее время стало привлекать внимание многих исследователей. Описаны, в частности, комплексные соединения рзэ с комплексонами и рядом органических кислот [3, 4], а также неорганическими заместителями - карбонатами [5, 6].
В связи с тем, что церий широко применяют в металлургии в качестве присадки в сталях и для модифицирования чугуна, а также легирующего компонента в легких сплавах на основе магния и алюминия, стало необходимо его количественное определение.
Одной из наиболее устойчивых комплексных форм, пригодных в аналитических целях, оказались цитратные комплексные соединения Ce(IV), дающие яркую и устойчивую окраску. Однако о составе образующихся при этом соединений нет точных данных [6].
Для того, чтобы восполнить имеющийся пробел, было исследовано комплексообразование Ce(III) и Ce(IV) с цитратом натрия. Ниже приведены данные о составе и свойствах образующихся комплексных соединений.
С учетом высокой реакционной способности солей церия с цитратами щелочных металлов были синтезированы цитраты церия при соблюдении стехиометрических соотношений реагентов:
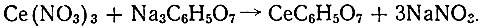
Сразу же после сливания растворов выделяется белый, хлопьевидный осадок, плохо растворимый в воде. Состав осадка, высушенного до постоянного веса при 105° С, по данным химического анализа, может быть выражен формулой СеС6Н5O7 × 3Н2O:
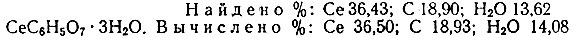
В 100 мл воды при 20° С растворяется всего 0,02 г выделенного вещества; в разбавленных кислотах и щелочах, а также в растворе цитрата это вещество растворяется хорошо.
При соотношении Се: Cit =1:2 реакция протекает с образованием комплексного соединения по следующей схеме:
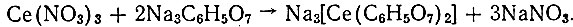
Выделившийся на первой стадии осадок цитрата церия постепенно растворяется при добавлении второй половины раствора цитрата натрия. Нагревание раствора до 50°С заметно ускоряет растворение осадка. В полученном таким образом растворе ион Се3+ не обнаруживается обычными осадителями - С2O4 , [Fe(CN)6]4-, а при подщелачивании раствора - даже F-.
Из охлажденного раствора спирт (метиловый или этиловый), а также ацетон выделяют мелкокристаллический порошкообразный осадок. По данным химического анализа, состав осадка, высушенного при 105° С, соответствует, по-видимому, формуле Na3 [Се (С6Н5O7)2]× 3Н2O:
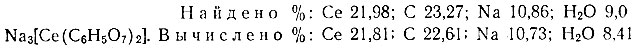
Строение этого комплексного соединения можно представить так:
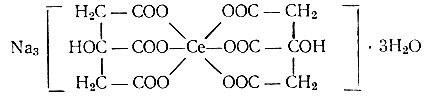
Координационная емкость церия, равная шести, насыщается двумя остатками лимонной кислоты, присоединяющимися через атомы кислорода карбоксильных групп.
Были получены комплексные дицитраты церия с различными щелочными металлами во внешней сфере Me3[Ce(C6H5O7)2], где Me = Na, Кг NH4. Добавление к раствору комплексного соединения солей тяжелых металлов приводит к замещению во внешней сфере с образованием труднорастворимых осадков. В частности, добавление соли Се (III) приводит к мгновенному выделению белого хлопьевидного осадка. По данным анализа, этот осадок соответствует простому цитрату церия. Однако образующееся соединение, вероятно, следует рассматривать как продукт замещения во внешней сфере дицитратного комплекса:
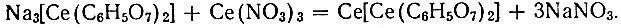
Аналитически оба соединения (СеС6Н5O7 и Се[Се(С6Н5O7)2])-одинаковы. Молекулярный вес соединений не был определен вследствие их плохой растворимости.
В кислой среде дицитрат церия неустойчив; ион церия в этих условиях легко обнаруживается любым из осадителей рзэ. При подщелачивании раствор постепенно приобретает оранжевую окраску вследствие окисления церия до четырехвалентного состояния.
Для получения комплексного цитрата Се(IV) поступали следующим образом. Растворы, содержащие 0,8446 г Ce(NO3)3 × 6Н2O в 5 мл воды и 2,0882 г Na3C6H5O7×5H2O в 10 мл воды, тщательно перемешивали. В прозрачную смесь добавляли 10 мл 30%-ной Н2O2; после нагревания до 40° С раствор оставляли на 10-20 мин. до появления стабильной темно-коричневой окраски. В окрашенный раствор, содержащий Се(IV), добавляли 70 мл ацетона; при этом выделялась тяжелая, маслянистая, темная жидкость, хорошо растворимая в воде. Для получения чисхого от примесей комплексного соединения операцию осаждения ацетоном повторяли дважды; водно-ацетоновый слой удаляли сливанием. Маслянистая жидкость, высушенная в эксикаторе над H2SO4, превращалась в темно-бурый порошок.
По-видимому, взаимодействие продуктов реакции происходит по такой схеме:
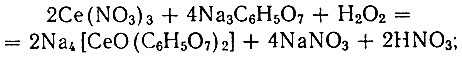
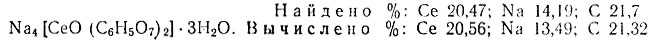
В соединении Na4 [СеО(С6Н5O7)2] × 3Н2O комплексообразователь - церинил-ион, который так же, как ион Се3+, имеет координационную емкость, равную шести. Это соединение хорошо растворимо в воде, pH его 1 М раствора 6,26; 0,5 М - 6,46. Его водные растворы очень устойчивы и сохраняются продолжительное время. Минеральные кислоты разлагают это соединение, а Се (IV) в кислой среде восстанавливается до Се(III). Аммиак разлагает это соединение на Се(ОН)4 и цитрат натрия. Из аммиачной среды ацетоном выделяется смесь Се(ОН)4 и цитрата натрия. После высушивания эта смесь разделяется на растворимый в воде цитрат натрия и нерастворимый коричневый осадок Се (ОН)4. Высушивать при повышенной температуре этот комплекс нельзя, так как уже при 110° С он белеет с выделением большого количества газообразных продуктов, очевидно, переходя в соединения Се (III).
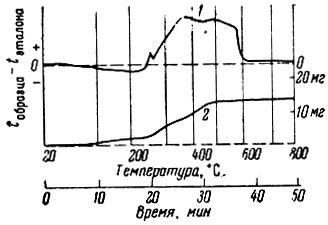
Рис. 1. Кривая нагревания (1) и сопряженная ей кривая изменения веса (2) для СеC6H5O7×3H2O (навеска 31,7 мг, потеря веса 15,8 мг)
![Рис. 2. Кривая нагревания (1) и сопряженная ей кривая изменения веса (2) для Na3[СеCHO6,5,7]× 3HO2 (навеска 37,6 мг, потеря веса 20,5 мг)](pic/000268.jpg)
Рис. 2. Кривая нагревания (1) и сопряженная ей кривая изменения веса (2) для Na3[СеC6H5O7]×3H2O (навеска 37,6 мг, потеря веса 20,5 мг)
![Рис. 3. Кривая нагревания (1) и сопряженная ей кривая изменения веса (2) для Na4[СеCHO6,5,7]× 3HO2 (навеска 38,3 мг, потеря веса 16,2 мг)](pic/000269.jpg)
Рис. 3. Кривая нагревания (1) и сопряженная ей кривая изменения веса (2) для Na4[СеC6H5O7]×3H2O (навеска 38,3 мг, потеря веса 16,2 мг)
Для всех форм комплексных цитратов церия были получены дифференциальные кривые нагревания и синхронные им кривые изменения веса при нагревании. На рис. 1 такие кривые приведены для простой соли СеС6Н5O7 × 3Н2O. Их ход показывает, что кристаллизационная вода теряется плавно до 200° С без разложения соединения. Около 240° С начинается разложение самой соли, которое заканчивается при 500-600° С.
На рис. 2 представлены кривые для комплексного соединения Na3[Се(С6Н5O7)2] × 3Н2O, где также видна плавная потеря кристаллизационной воды, а затем разложение цитрата с одновременной потерей веса примерно в тех же температурных интервалах, что и для первого соединения.
Для комплексного соединения с церинил-ионом Na4[CeO(C6H5O7)2] × 3Н2O данные показаны на рис. 3. Кривая нагревания 1 для этого комплекса резко отличается от кривых для первых двух соединений. Здесь виден резкий максимум при 120° С, который соответствует перестройке церинила, т. е. переходу Ce(IV) в Се(Ш). Это явление весьма наглядно можно наблюдать при нагревании соединения даже в пробирке. Кривая потери веса мало отличается от первых двух - происходит плавная потеря кристаллизационной воды, а затем разложение цитрата.
Литература
- Д. И. Рябчиков, Е. А. Терентьева. Изв. АН СССР, ОХН, № 1,
- Д. И. Рябчиков, Е. A. Tерентьева. ДАН СССР, 51, 287 (1947).
- В. В. Серебренников, Е. И. Иванова, Л. А. Алексеенко. 1377 (1959).
- Н. А. Костромина. ЖНХ, 5, 95 (1960).
- В. А. Головня, Л. А. Поспелова. ЖНХ, 3, 2253 (1958).
- Д. И. Рябчиков, 3. Г. Стрелкова. ЖАХ, 3, 226 (1948).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'