
Комплексные моноцитраты и мононитрило-триацетаты редкоземельных элементов (Д.И. Рябчиков, Е.К. Корчемная)
Систематическое изучение комплексообразования рзэ с различными солями органических кислот, в том числе и цитратом [1], показало, что наличие гидроксильной группы в составе молекулы лиганда существенно увеличивает прочность получающегося комплексного соединения. Можно было предположить, что в образовании координационной связи с ионом рзэ принимает участие при известных условиях и кислород гидроксила наряду с кислородом карбоксила лиганда. Поэтому возник самостоятельный вопрос о возможной координации ионом рзэ свободного гидроксила, хотя, как известно, щелочь - осадитель этих элементов.
Ниже приведены результаты изучения монокомплексов рзэ с цитратом натрия и трилоном А, имеющим, как и цитрат, три карбоксильные группы, но не содержащим гидроксилов.
Изучение взаимодействия цитратов щелочных металлов с солями рзэ [2] было первым исследованием, показавшим, что они являются энергичными комплексообразователями. Реакция протекает в эквимо-лекулярных количествах, а при соотношении Ln : Cit = 1 : 2 образуется очень прочное комплексное соединение:
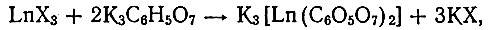
где Ln = La - Lu; X = Cl- , NO-3 и др.
Как было установлено [3], рзэ осуществляют координационную связь с лигандами преимущественно через атомы кислорода или третичного азота и обнаруживают координационную емкость, равную
шести. При помощи ряда осадителей: PO3-4 > F > С2О2-4 > ОН > [Fe(CN)6]4- - удалось доказать, что комплексообразующая способность этой группы элементов с любым из лигандов увеличивается с уменьшением ионного радиуса от La к Lu. Прочность комплексных соединений рзэ резко зависит от pH среды и, как правило, уменьшается с увеличением кислотности.
Однако ранее не были подробно изучены продукты взаимодействия рзэ с цитратами щелочных металлов при меньшем соотношении: Ln : Cit = 1:1, так как образующийся первоначально осадок рассматривали как простой цитрат.
Более детальное изучение осадка, выделяющегося при соотношении Ln : Cit = 1:1, показало, что и в этом случае образуется комплексное
соединение. При растворении его в воде ион рзэ нельзя обнаружить действием K4[Fe(CN)6], осадок появляется лишь после подкисления раствора. Очень характерно, что в ряду рзэ и в данном случае наблюдается общая тенденция повышения прочности комплексов. Так, например, реакция с ферроцианидом калия отрицательна для всех рзэ;. с оксалатом она наблюдается у La, Nd, Gd, тогда как у Y и Еr осадки уже не образуются.
Особо обращает на себя внимание то, что добавление едкого натра приводит к растворению комплекса, в то время как щелочь - один из лучших осадителей рзэ. Несмотря на то, что добавление моля NaOH увеличивает pH раствора до 9, комплексное соединение заметно упрочняется: ион лантана не выделяется из подщелоченного раствора не только ферроцианидом калия, как описано выше, но даже и таким энергичным осадителем, как фторид натрия.
Данные анализа показывают, что осадок, образующийся при отношении Ln : Cit = 1 : 1, в случае лантана имеет состав [LaC6H5O7 × 3Н2O].
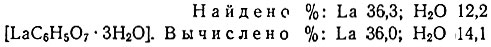
Указанное соединение можно рассматривать как неэлектролит, в котором шесть координационных мест лантана заняты остатком цитрата и тремя молекулами воды. В водном растворе соединение превращается в электролит, причем металл оказывается в составе аниона, что убедительно доказывается его количественным переносом в анодное пространство. Опыты проводили в присутствии Еu 152,154.
Это обстоятельство дает основание предположить, что в процессе растворения вещества происходит внутри сферная диссоциация одной молекулы воды с образованием электролита по реакции:
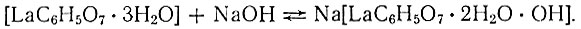
При растворении осадка цитраттриакво-лантана в одном моле едкого натра диссоциация одной молекулы внутрисферной воды, как видно, проходит до конца с образованием натриевой соли комплексного соединения лантана по реакции:
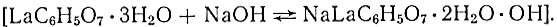
Осадок, выделенный из щелочного раствора спиртом, согласно анализу, близко подходит к формуле Na[LaC6H5O7 × 2Н2O × ОН].
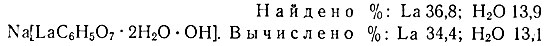
При взаимодействии 0,1 М растворов LaCl3 и трилона А (1 : 1) получается прозрачный раствор, из которого, спустя примерно 10-15 мин., выделяется мелкокристаллический осадок. Последний чрезвычайно гигроскопичен; его состав после высушивания над H2SO4 соответствует формуле [LaTA × 2Н2O]*
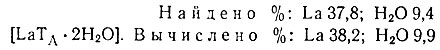
* (Остаток трилона А N(СН2СОО)3 обозначается в тексте ТА)
Реакции осадителей рзэ указывают на наличие в фильтрате комплексного соединения: с K4[Fe(CN)6] и NaF осадки образуются только - после подкисления раствора.
Осадки, выделенные спиртом из такого фильтрата, не гигроскопичны и поэтому высушены на воздухе. Состав их может быть выражен формулой [LaTA×3H2O]:
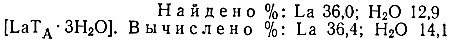
Любопытно, что при сливании равных объемов 0,1 М растворов LaCl3(pH 4) и трилона А(рН 10) получающийся раствор имеет pH 4. Такое явление, по-видимому, может быть объяснено мобилизацией ионов водорода за счет диссоциации внутрисферной воды в образующемся комплексном соединении.
Если тотчас же после добавления раствора трилона А к раствору LaCl3 прилить спирт, то выделится мелкокристаллический осадок, состав которого после высушивания на воздухе соответствует формуле [LaТA×3Н2O]:
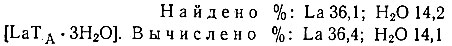
Можно полагать, что в растворе за счет внутрисферной диссоциации образуется комплексная форма состава Н[LaТA × 2Н2O × ОН]. Однако обе
эти формы, по всей вероятности, в растворе находятся в равновесии:
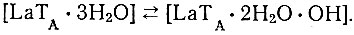
При подщелачивании это равновесие будет сдвигаться вправо, тогда как при добавлении спирта, понижающего диэлектрическую постоянную- среды, равновесие сдвинется влево, в сторону образования не электролита.
Несколько иная картина наблюдается, если реакцию проводить в щелочной среде.
При постепенном добавлении раствора едкого натра к раствору, содержащему LaCl3 и трилон А (1:1), образуется нарастающая муть,, которая растворяется в присутствии моля NaOH. При добавлении 1 или 2 молей NaOH раствор длительное время остается прозрачным.
Осадок, выделенный спиртом из прозрачного подщелоченного раствора, после высушивания на воздухе представляет небольшие прозрачные кристаллы, подобные сахарному песку. Состав такого осадка, по-видимому, ближе всего соответствует формуле [LaTA × 2Н2O]:
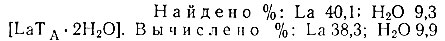
Может быть это различие по сравнению с составом осадка, выделенного из раствора в отсутствие NaOH, связано с тем, что в щелочной среде усиливается комплексообразующая способность азотного конца трилона, благодаря чему азот также будет участвовать в образовании координационной связи, а остаток ТA займет четыре координационных места. Два оставшихся места займут две молекулы Н2O.
Следует отметить, что осадки, высушенные над H2SO4 и полученные разными методами, теряют одну молекулу внутри сферной воды; их состав соответствует формуле [ЬаТА*2Н2O].
Соль с двумя молекулами Н2O очень гигроскопична и на воздухе поглощает еще моль воды.
При взаимодействии LaCl3 и трилона А (1 : 2; 0,5 М растворы) постепенно выделяется осадок, который растворяется при добавлении двух кратного избытка трилона А.
При добавлении к раствору в случае лантана осадителей рзэ (K4[Fe(CN)6], (NH4)2С2О4, NaOH, NaF) осадок тотчас же дает лишь (NH4)2C2O4, в случае же эрбия осадки не выпадают, лишь на следующий день образуется небольшая муть с (NH4)2C2O4 и NaF.
Осадки, выделенные спиртом из раствора, содержащего LaCl3 и трилон А (1:2), очень гигроскопичны и высушены до постоянного веса в эксикаторе над H2SO4. Состав таких осадков может быть выражен формулой Na3[La2TA ] × 2Н2O:
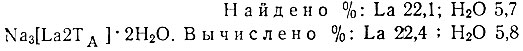
Аналогично при добавлении к раствору LaCl3 и трилона А (1:2) раствора NaOH начинает выпадать осадок, который затем растворяется в присутствии моля NaOH.
Из такого раствора спиртом выделяется осадок Na3 [Lа2ТA ] × 2Н2O;
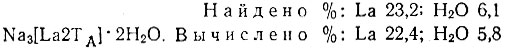
Знак заряда комплексных соединений устанавливали электрофоретическим методом в присутствии Еu152,154.
Полученные экспериментальные данные согласуются с результатами исследований Бека [4] и Викери [5], которые привели предположительные формулы комплексных соединений рзэ с трилоном А, а также Буланже [6]. Последний, однако, не определял содержания воды в этих комплексах.
Литература
- Д. И. Рябчиков, Е. К. Корчемная. ДАН СССР, 138, 397 (1961).
- Д. И. Рябчиков, Е. А. Терентьева. ДАН СССР, 58, 1373 (1947).
- Д. И. Рябчиков, Е. А. Терентьева. Изв. АН СССР, ОХН, № 1, 44 (1949).
- G. Beck. Helv. chim. acta, 29, 357 (1946).
- R. C. Vickery. Ind. Chemist, a. Chem. Manufactur., 29, 260 (1953).
- F. Boulanger. Chim. analyt., 35, 253 (1953).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'