
Комплексообразование как основа методов разделения редкоземельных элементов (Д.И. Рябчиков, Е.А. Терентьева)
Исследования, связанные с выделением отдельных рзэ в чистом виде и изучением их свойств, как известно, потребовали колоссальных усилий крупнейших химиков XIX и XX столетий. Однако такие работы особенно широко развернулись в послевоенный период в связи с решением проблемы атомной энергии. Так как рзэ обладают максимальной способностью к захвату тепловых нейтронов, возникла необходимость их отделения на всех стадиях переработки урана.
Развитие атомной техники, электроники и других областей науки потребовало новых материалов с разнообразными физическими и химическими свойствами. Естественно, исследователи обратили внимание на многочисленную группу рзэ, свойства которых были еще мало изучены. Стал непрерывно возрастать спрос на различные препараты рзэ, в частности, чистые металлы, бориды, карбиды и др.
В наших обзорах [1] дается подробная сводка методов разделения природной суммы рзэ и очистки индивидуальных элементов.
В современных методах разделения рзэ решающее значение имеет их комплексообразующая способность.
Следует отметить, что большой материал по химии рзэ, накопленный более чем за столетие, касается преимущественно простейших типов неорганических и органических соединений. Однако сложномолекулярные соединения комплексного типа этой группы элементов до недавнего времени почти не изучались.
Первые сведения об аномальном поведении некоторых соединений рзэ были получены еще Берцелиусом в начале прошлого века, когда он наблюдал, что выделение их гидроокисей предупреждается добавлением винной кислоты. Позже в литературе стали появляться отдельные сообщения о сложно-молекулярных соединениях рзэ с ацетилацетоном и другими дикетонами, полифенолами, а также рядом органических азот-производных. Вопрос же о комплексообразовании рзэ принципиально не ставился ни одним из авторов. Более того, среди химиков было весьма распространено .мнение о невозможности образования комплексных соединений этой группой элементов. Таково примерно было состояние вопроса к 1944 г., когда нами были начаты соответствующие исследования, продолжающиеся и по настоящее время.
Для обнаружения в растворе комплексных соединений и определения их относительной устойчивости был разработан очень простой метод ряда осадителей. Было установлено, что по способности разрушать комплексные соединения рзэ ионы-осадители располагаются в следующий ряд: F- > С2O2- > ОН- > [Fe(CN)6]4-, совпадающий с рядом убывающих значений произведений растворимости соответствующих труднорастворимых соединений рзэ. Отсутствие характерной реакции при действии того или другого реактива служило критерием относительной устойчивости комплексных соединений в растворе.
Оказалось, что рзэ в смысле комплексообразования существенно отличаются от других тяжелых элементов, в частности, группы платиновых металлов. С большинством неорганических координационных заместителей, даже таких активных, как S2O3 , CN-, NO2 , NH3, J-, рзэ не вступают в не ионогенную связь или, если и дают с ними комплексные соединения, то очень мало устойчивые. Чаще всего рзэ взаимодействуют с органическими веществами, в частности, с органическими кислотами различных классов [2]: одноосновными (уксусной, гликолевой, молочной), двухосновными (щавелевой, малоновой, янтарной, глутаро- вой, адипиновой, пимелиновой, азелаиновой, себациновой) двухосновными непредельными (малеиновой, фумаровой, цитраконовой), окси-кислотами - двухосновными (винной, слизевой, сахарной) и трехосновными (трикарбаллиловой, аконитовой, лимонной), аминокислотами (гликоколем, α-аланином, аспарагиновой, глутаминовой), аминополи- уксусными (нитрилотриуксусной и этилендиаминтетрауксусной), сульфокислотами (антрахинонсульфокислотой, α-амино-β-сульфокислотой, нафталинтрисульфокислотой).
Наиболее детально было изучено комплексообразование рзэ с лимонной кислотой и ее солями [3]. Многими методами, в том числе на основе данных химического анализа, установлено, что в избытке цитрат-иона всегда образуется комплексный анион состава [LnIII(C6H5O7)2]3-. Внутренняя сфера комплекса насыщается двумя остатками лимонной кислоты, причем каждый остаток занимает три координационных места. Лиганды присоединяются к комплексообразователю циклом посредством атомов кислорода карбоксильных групп. Это обстоятельство объясняет высокую прочность цитратных комплексов рзэ в нейтральной и особенно в щелочной средах. При подкислении устойчивость цитратных комплексов ослабевает настолько, что ион рзэ легко обнаруживается всеми осадителями и сорбируется катионитом. Во внешней сфере комплексного соединения размещаются катионы щелочных, щелочноземельных металлов или аммония. Так, для La, Рr и Nd были получены комплексные соли состава Ca3[Ln(С6Н5O7)2]2. Интересно отметить, что такая соль лантана обладает значительно меньшей растворимостью в воде, чем соли остальных элементов цериевой подгруппы. Можно получать комплексные цитраты, в наружной сфере которых находятся также ионы рзэ, например Ce:[Nd(C6H5O7)2].
Как показали исследования Рябчикова и Корчемной [4], комплексные цитраты рзэ образуются также и при соотношении Ln:Cit = 1:1. При взаимодействии цитрата щелочного металла с солью рзэ выделяется осадок комплексного цитрата рзэ [LnC6H5O7 × 3Н2О], который при подщелачивании легко растворяется с образованием также комплексного соединения состава Na [МеС6Н5O7 × 2Н2O]. В этом случае, по-видимому, остаток лимонной кислоты мобилизует еще одну связь за счет кислорода гидроксильной группы и в целом занимает четыре координационных места. К двум оставшимся дополнительным связям центрального атома присоединяются две молекулы воды.
Представляют интерес наблюдения, сделанные в отношении комплексных соединений рзэ с двухосновными непредельными кислотами- изомерами - малеиновой и фумаровой:
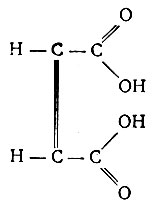
цис-форма (малеиновая)
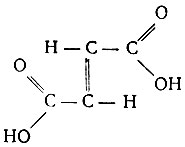
транс-форма (фумаровая)
Под действием температуры, света, галоидоводородных кислот и т. д. менее устойчивая малеиновая кислота переходит в более устойчивую., фумаровую. Малеиновая кислота, так же как и двухосновные насыщенные кислоты,- с рзэ дает растворимые комплексные соединения типа
В фумаровой кислоте не может образоваться комплексное соединение; поэтому здесь сразу выпадают труднорастворимые простые соли. При стоянии (или нагревании) в присутствии НВг происходит постепенное превращение легкорастворимых комплексных малеинатов рзэ в труднорастворимые соли фумаровой кислоты. Если бы оказалось, что фумараты различных рзэ имеют различную растворимость, то можно было бы отделять фракции, содержащие концентраты отдельных компонентов. Это могло быть положено в основу нового метода разделения смесей рзэ.
Цитраконовая кислота СН3 - С(СООН) = С(СООН)- Н, так же как и малеиновая, имеет цис-строение. Она легко превращается в трансформумезаконевую кислоту. По отношению к солям рзэ цитраконовая кислота ведет себя аналогично малеиновой-дает растворимые в воде комплексные соединения, не разрушающиеся при действии K4[Fe(CN)6] и NH4OH. Можно предположить, что растворимые комплексные соединения цитраконовой кислоты будут переходить в труднорастворимые мезаконаты рзэ [5].
Были получены также комплексные соединения рзэ катионного типа. Рзэ весьма энергично взаимодействуют с некоторыми сложными органическими аминами, в частности, с фенилдиметилпиразолоном (антипирином) и диметилантипирином (пирамидоном) [6].
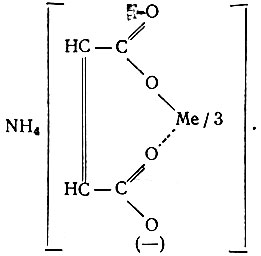
Антипирин C11H12ON2 взаимодействует с солями рзэ цериевой подгруппы по такой схеме:
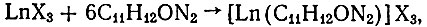
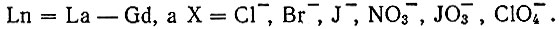
Реакция протекает при стехиометрических соотношениях практически мгновенно. Все шесть координационных мест у иона рзэ насыщаются шестью молекулами амина, каждая из которых присоединяется к комплексообразователю посредством атома азота, занимая во внутренней сфере лишь одно координационное место.
Существенно иная картина наблюдается при взаимодействии антипирина с рзэ иттриевой подгруппы. В молекуле этого амина имеется два атома азота, посредством которых она может присоединяться к металлу, образуя замкнутый цикл. Однако эта возможность полностью реализуется лишь у металлов иттриевой подгруппы - более сильных комплексообразователей. С этими металлами взаимодействие амина протекает так:
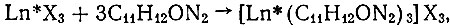
где Ln* = Gd - Lu, а X - те же кислотные остатки.
В соединениях такого состава молекула амина, вследствие замыкания цикла во внутренней сфере, занимает два координационных места.
Из ряда полученных комплексных аминов рзэ перхлораты состава [Ln(C11H12ON2)6](Cl4)3 и [Ln*(C11H12ON2)3](ClO4)3 резко отличаются своей меньшей растворимостью. Нам не удалось получить аминокомплексов с кислотными остатками F-, С2O4 , SO4 во внешней сфере. Сродство этих анионов с ионами рзэ так велико, что при их взаимодействии с аминокомплексом происходит разрушение внутренней сферы соединения, а в результате образуются труднорастворимые осадки простых солей металла с этими кислотными остатками.
Взаимодействие солей рзэ с N-диметилантипирином почти повторяет рассмотренные выше реакции с антипирином. В связи с тем, что в составе этого амина из трех атомов азота два связаны с метильными группами, его молекула оказывается более реакционноспособной по сравнению с антипирином. Во всем ряду рзэ молекула N-диметилантипирина способна занимать по два координационных места:
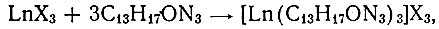
где Ln = La - Lu, a X - те же кислотные остатки.
Оба амина с солями рзэ образуют очень сходные по составу и свойствам, но недостаточно прочные комплексные соединения.
Весьма интересны продукты взаимодействия аминокомплексов рзэ с комплексными хромороданидами состава K3[Cr(SCN)6] и NH4[Cr(SCN)4(NH3)2], образующиеся согласно следующим уравнениям реакций:
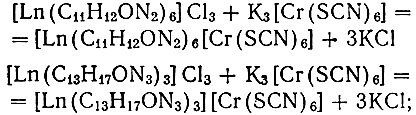 (1)
(1)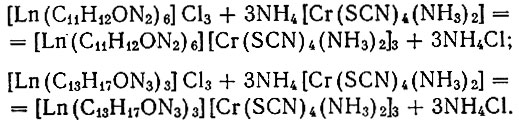 (2)
(2)Сложномолекулярные соединения выделяются в виде труднорастворимых окрашенных осадков - сиреневых в первом и розовых во втором случае. Кристаллическая форма образующихся соединений различна в каждой из подгрупп металлов.
Метод "ряда осадителей", а также разработанный Сенявиным и Тихоновой [7] хроматографический метод позволили оценить устойчивость комплексных соединений рзэ. Оказалось, что устойчивость комплексных соединений зависит от основности органической кислоты, длины углеводородной цепи, ее строения, характера и взаимного расположения функциональных групп. Существенное значение имеют также и пространственные эффекты. В частности, введение СООН-, SO3H-, а также ОН- - групп в близкое положение к СООН- - группе, а также наличие двойной связи влечет за собой повышение устойчивости комплексных соединений рзэ. Удлинение углеводородной цепи, введение фенил-радикала, замена СООН-группы на ЫОг-группу, наоборот, понижает устойчивость комплексных соединений. Аминогруппа и ОН- - группы в β- и γ-положениях практически не влияют на устойчивость комплексных соединений рзэ. Опубликованные за последние годы данные отечественных и зарубежных авторов по химии комплексных соединений рзэ находятся в соответствии с основными положениями о комплексообразовании рзэ, высказанными нами ранее.
Все шире в химии рзэ применяют органические комплексообразующие вещества: уксусную, щавелевую, гликолевую, молочную, триоксиглутаровую, глюконовую и салициловую кислоты, а также антипирин и пирамидон. Большое распространение получили аминополиуксусные кислоты: этилендиаминтетрауксусная, оксиэтилэтилендиаминтетра- уксусная, диэтилентриаминпентауксусная, диаминциклогексантетраук- сусная и другие. Испытываются все новые кислоты, отличающиеся числом ацетатных групп и их взаимным расположением.
Полученный нами обширный экспериментальный материал позволил сделать выводы, имеющие самостоятельное значение для неорганической химии, в частности для химии рзэ.
Так, рзэ - довольно энергичные комплексообразователи, осуществляющие связь с лигандами преимущественно через атом кислорода и реже - через атом третичного азота. Комплексообразующая способность рзэ с любым лигандом увеличивается с уменьшением ионного радиуса элемента в ряду La - Lu. Прочность всех типов комплексных соединений рзэ в значительной степени зависит от pH среды и, как правило, уменьшается с увеличением кислотности. У всех рзэ в трехвалентном состоянии координационное число равно шести.
В практике получения индивидуальных рзэ обычно последовательно выполняются сложные операции: выделение суммы рзэ из природного материала; разделение ее на две подгруппы (цериевую и иттриевую); отделение превалирующих рзэ (La, Се и Y) и разделение оставшейся смеси. Для этих практических целей используют различные методы в зависимости от характера исходного сырья, соотношения компонентов и требуемой чистоты.
Для деления на цериевую и иттриевую подгруппы уже давно применяют сульфаты, карбонаты, формиаты и некоторые другие соли щелочных металлов. Во всех случаях образующиеся соединения элементов цериевой подгруппы преимущественно выделяются в осадок, а соединения иттриевой подгруппы - в основном остаются в растворе. Обычно считают, что разделение на подгруппы обусловлено различием в растворимости соответствующих двойных солей. Однако, как было показано Рябчиковым и Скляренко [8] на примере "двойных" карбонатов рзэ и щелочных металлов, механизм деления на подгруппы связан с явлением комплексообразования. На основании анализа твердой фазы было установлено, что в осадок выпадают не двойные соли, а нормальные карбонаты состава LnIII2(CO3)3 × nН2O. Растворимость же у элементов второй половины группы рзэ - следствие образования ионом рзэ комплексных соединений Na3[LnIII(СО)3]3.
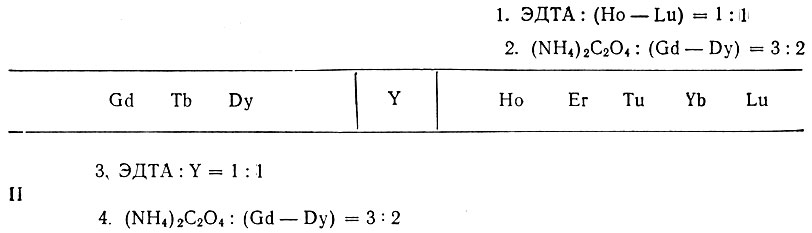
Деление на подгруппы может быть осуществлено лишь при определенных соотношениях растворимых солей рзэ и щелочного карбоната. При очень большом избытке последнего рзэ полностью могут перейти в растворимую комплексную форму. Это обстоятельство может быть использовано, в частности, для разделения цериевых земель на небольшие подгруппы. Однако для разделения всего ряда рзэ на такие подгруппы целесообразнее использовать более сильные комплексообразующие лиганды, чем карбонат. Исследования Вагиной и Рябчикова [9], проведенные с трилоном Б, доказали возможность разделения всей суммы рзэ на ряд небольших подгрупп и отделения превалирующего количества иттрия, что важно при получении тяжелых рзэ ионообменным методом. При этом следует строго соблюдать соотношение между комплексообразующими компонентами и вводимым во второй стадии процесса осадителем. Отделение основной массы иттрия этим методом при pH 5 можно представить такой схемой:
Значение процесса комплексообразования при хроматографическом разделении смесей рзэ особенно наглядно подтверждается сравнением первых неудачных опытов по простому вытеснению с работами последних лет. Хотя при хроматографическом разделении и оказывает влияние выбор ионообменного сорбента, все же решающим в этом процессе является комплексообразование рзэ с лигандом. В интервале узких значений pH создаются условия, при которых элюант последовательно переводит в подвижное состояние в форме комплексного аниона более тяжелые рзэ. Описан детально химизм элементарного акта [10].
Рябухин [11] сравнил разделяющую способность наиболее распространенных комплексообразующих агентов, применяемых в хроматографическом процессе разделения рзэ (лимонной, этилендиаминтетрауксусной (ЭДТА) и нитрилотриуксусной (HTA) кислотами в присутствии соответствующих радиоактивных изотопов). При оптимальных
параметрах процесса в динамических условиях измерены коэффициенты распределения некоторых рзэ, по которым вычислены факторы разделения. Соответствующие факторы приведены в таблице.
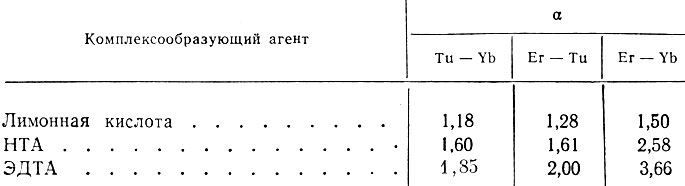
Факторы разделения а для Tu - Yb, Еr - Tu и Er - Yb
На основании полученных данных исследованные кислоты по их разделяющей способности располагаются в ряд:
ЭДТА > НТА > лимонная кислота.
Сенявин и Клинаев [12] разработали экстракционный метод отделения Се (IV) в виде комплекс- ной кислоты состава Н4[Се(NO3)8]- Комплексообразование Се(IV) используют для его отделения от остальных рзэ другими химическими методами. Так, метод Орлова [13] основан на устойчивости комплексного оксалата (NH4)4 [Се(С2O4)4]. С оксалатами щелочных металлов и аммония образуют комплексные соединения Na3[Ln(C2O4)3] и последние члены иттриевой подгруппы. Это всегда следует иметь в виду при выделении рзэ из природного материала и аналитических исследованиях. Комплексообразование рзэ с этими реагентами может быть использовано и при разделении иттриевой подгруппы.
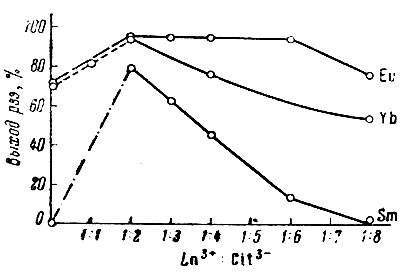
Зависимость выхода Yb, Sm, Eu от отношения Ln3+ : Cit3-
Полное выделение Eu, Sm и Yb при электролитическом восстановлении их на ртутном катоде из ацетатноцитратных растворов стало возможно после изучения Рябчиковым, Скляренко и Строгановой [14] химизма этого метода. Как выяснилось, имеющее здесь место комплексообразование является решающим и поэтому соотношение комплексообразующих компонентов и кислотности среды очень сильно влияет на пол-ноту выделения этих рзэ (см. рисунок).
Из рассмотренных примеров ясно видна исключительная роль комплексообразующей способности рзэ в практике выделения каждого из них из сложной смеси природных материалов.
Литература
- Д. И. Рябчиков, Е. А. Терентьева. Усп. хим., 16, 462 (1947); 24, 260 (1955); 29, 1285 (1960).
- Д. И. Рябчиков, Е. А. Тереитьева. ДАН СССР, 51, 287 (1946).
- Д. И. Рябчиков, Е. А. Терентьева. ДАН СССР, 58, 1373 (1947).
- Д. И. Рябчиков, Е. К. Корчемная. ДАН СССР, 138, 397 (1961).
- Е. А. Терентьева. Диссертация. МГУ, 1951.
- Д. И. Рябчиков, Е. А. Терентьева. Изв. АН СССР, ОХН, № 1, 44 (1949).
- М. М. Сенявин, Л. И. Тихонова. ЖНХ, 1, 2772 (1956).
- Д. И. Рябчиков, М. М. Сенявин, Ю. С. Скляренко. Труды Второй Международной конференции по мирному использованию атомной энергии. Женева, 1958. Доклады советских ученых. М., Атдмиздат, 1960, стр. 75.
- Д. И. Рябчиков, Н. С. Вагина. ЖНХ, 2, 1522 (1957); 5, 102, 356 (1960).
- Д. И. Рябчиков, М. М. Сенявин. Сб.: "Применение меченых атомов в аналитической химии". М., Изд-во АН СССР, 1955.
- В. А. Рябухин. Диссертация. М., ГЕОХИ АН СССР, 1958.
- В. М. Клинаев, М. М. Сенявин. Сб.: "Применение меченых атомов в аналитической химии". М., Изд-во АН СССР, 1955.
- Н. А. Орлов. CIMI. П. Н. Чирвинский. Труды Минералогического музея АН СССР, т. 2. М, Изд-во АН СССР, 1927.
- Д. И. Рябчиков, Ю. С. Скляренко, Н. С. Строганова. ЖНХ, 1, 1954 (1956); 4, 1985, 2682 (1959).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'