
Применение комплексообразующих реагентов в экстракционных процессах разделения редкоземельных элементов в растворах нитратов (Г.В. Корпусов, Е.П. Патрушева, Н.П. Петракова, B.Ф. Соколова)
Экстракционное извлечение элементов органическими растворителями в большинстве случаев можно рассматривать как процесс комплексообразования. Наиболее часто экстрагент - это одновременно комплексообразующий лиганд и растворитель образующихся комплексных соединений. Экстрагирование в основном осуществляется путем сольватирования извлекаемых соединений молекулами органического растворителя.
Эффективность экстракционного извлечения и разделения элементов может быть повышена введением в экстракционную систему специально подобранных комплексообразующих агентов [1-5].
Для разделения рзэ используют оксихинолин, купферон, тиофенкарбонилтрифторацетон (ТТА) и другие реагенты [6-16], образующие с рзэ прочные внутрикомплексные соединения с максимальным различием в константах устойчивости.
Низкая растворимость в водной фазе их комплексных соединений с рзэ и, как правило, недостаточно высокая растворимость в органической фазе - недостатки этих реагентов.
Имеется большая группа комплексообразующих агентов, которые так же, как и перечисленные выше, дают с рзэ прочные комплексы с большим различием в константах устойчивости, которые успешно применяют при разделении рзэ. К ним относятся этилендиаминтетра-уксусная, нитрилотриуксусная, диаминциклогексантетрауксусная кислоты и др.
Комплексные соединения рзэ с этими комплексообразующими лигандами хорошо растворимы в водных растворах и не растворимы в органических растворителях; поэтому их и не применяли в экстракции. Однако, учитывая доступность этих соединений, высокую растворимость их комплексных соединений с рзэ в водных растворах, большое различие в константах устойчивости комплексов рзэ, казалось перспективным найти условия их применения в экстракционных процессах. Это возможно в системе, где рзэ в отсутствии комплексообразующего агента полностью находятся в органической фазе (т. е. коэффициенты распределения нитратов рзэ между водной и органической фазами должны быть не менее 30).
В качестве экстрагентов, обеспечивающих столь высокие значения коэффициентов распределения, могут быть использованы фосфинокиси, фосфинаты, кислые фосфонаты и фосфаты. В случае экстракции рзэ нейтральными фосфонатами и фосфатами при pH 1-5 величины коэффициентов распределения недостаточно высоки. Для их увеличения в систему вводят высаливатели. Чем выше экстракционная способность растворителя, тем сильнее может быть снижена концентрация высаливателя.
Экстракционная способность растворителей возрастает в ряду фосфат-фосфонат-фосфинокись [17, 18].
В качестве высаливателей должны быть использованы катионы, дающие максимальный высаливающий эффект и имеющие низкую величину константы комплексообразования с применяемыми лигандами.
При использовании трибутилового эфира ортофосфорной кислоты (ТБФ) в качестве экстрагента мы применяли высаливатели LlNO3 или NH4NO3, концентрация которых в водной фазе составляет 7-8 М при использовании диизоамилового эфира метилфосфорной кислоты (ДАМФК) концентрация LiNO3 была снижена до 3 М. В качестве комплексообразующего реагента в водной фазе применяли преимущественно этилендиаминтетрауксусную кислоту (ЭДТА). Поэтому все закономерности разобраны на ее примере.
Константы устойчивости комплексов рзэ с ЭДТА и другими подобными соединениями были определены многими авторами [19-21]. В настоящей работе для расчетов использовали величины констант диссоциации ЭДТА и величины констант устойчивости ее комплексных соединений с рзэ, определенные Шварценбахом [22-24] (см. табл. 1). Для сравнения приведены значения констант устойчивости комплексных соединений ЭДТА с некоторыми другими катионами, которые применяли в наших системах.
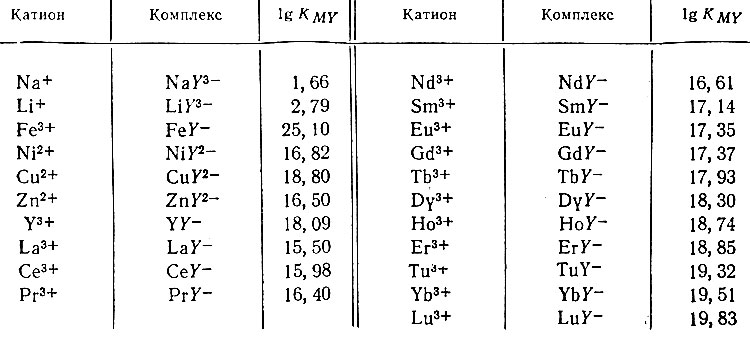
Таблица 1. Константы устойчивости комплексных соединений рзэ с ЭДТА при 20° С и ионной силе μ = 0,1 в среде КСl. рК1 = 2,0; pK2 = 2,76; рK3 = 6,16; pK4 = 10,26 для ЭДТА
Распределение рзэ в присутствии комплексообразующих реагентов определяется равновесиями, наблюдающимися в водной и органической фазах. Так как для разделения рзэ чаще всего используют нитраты, то все приведенные рассуждения относятся к нитратным системам; в принципе же они применимы к любым другим системам (хлоридным, сульфатным) .
Равновесия в водном растворе
В водном растворе ЭДТА диссоциирует в зависимости от pH раствора следующим образом:
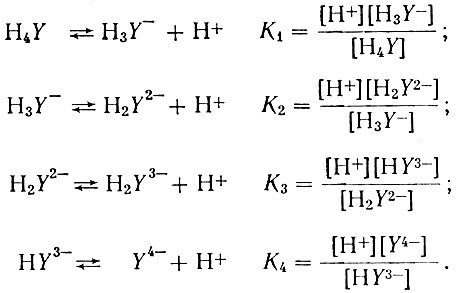
В то же время суммарная концентрация комплексона в водном растворе определяется следующим уравнением:
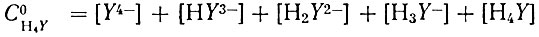 (2)
(2)или с учетом уравнения (1):
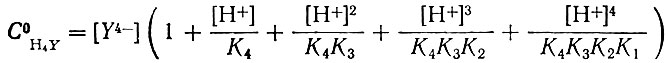
(3)
Выражение, заключенное в скобки, определяется лишь величиной pH. Зная pH раствора, можно определить концентрацию свободного лиганда:
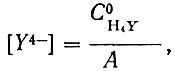 (4)
(4)где
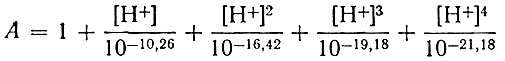
(в соответствии с приведенными значениями констант диссоциации ЭДТА).
В водном растворе Н4Y образует соединения с рзэ состава LnY-. Константа образования этого комплекса для реакции Ln3+ + Y4- = LnY- описывается следующим выражением:
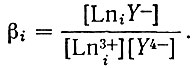 (5)
(5)В присутствии в растворе ионов других металлов (например, Li, Na, и других) также наблюдается комплексообразование с Н4Y по реакции Мn+ + Y4- = МYn-4 с соответствующей константой:
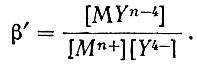 (6)
(6)и
Нитраты рзэ, в зависимости от концентрации нитрат-иона в растворе, могут присутствовать в различных формах:
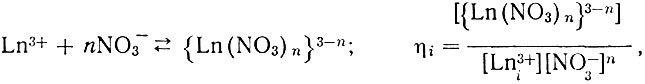 (7)
(7)где n меняется от 1 до 6.
Кроме того, в растворе при высоких значениях pH может происходить гидролиз ионов рзэ:
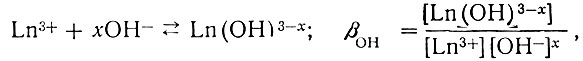 (8)
(8)где х меняется от 1 до 3.
При учете всех равновесий в водном растворе суммарная концентрация рзэ может быть выражена следующим образом:
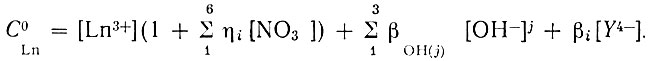 (9)
(9)Решая совместно уравнения (4), (5) и (9), для доли металла, закомплексованного ЭДТА, получим следующее уравнение:
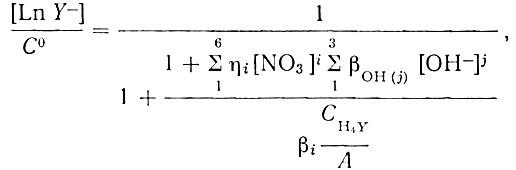 (10)
(10)где СH4Y - суммарная концентрация незакомплексованной формы Н4Y ЭДТА, выражаемая уравнением
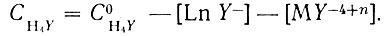 (11)
(11)На практике в уравнении (11) можно пренебречь членом, характеризующим связывание лиганда катионом высаливателя. Даже при максимальных концентрациях высаливателя (например 10 N раствор LiNO3) связывание комплексообразователя происходит в области pH > 6, т. е. вне пределов области разделения рзэ. Кроме того, значения pH раствора таковы, что практически можно пренебречь гидролизом ионов этих элементов.
Рассмотрим два частных случая связывания рзэ ЭДТА в водных растворах.
Рзэ присутствуют в микроколичествах и полностью диссоциированы. Лиганд находится в избытке. В этих условиях уравнение (10) приобретает такой вид:
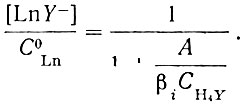 (12)
(12)Как следует из уравнения (12), область комплексообразования рзэ с ЭДТА зависит от ее концентрации и величины константы устойчивости образующегося комплекса рзэ с ЭДТА. На рис. 1 для примера показано
связывание лантана ЭДТА в зависимости от pH при изменении концентрации ЭДТА от 1 до 10-4 М. На рис. 2 показана та же зависимость для двух крайних элементов - лютеция и лантана - при концентрации ЭДТА 10-2 М. Вся область комплексообразования рзэ укладывается в - 1-2 единицы pH. В табл. 2 приведены значения pH, при которых 50% рзэ связывается в комплекс с ЭДТА, рассчитанные для тех же условий, которые указаны на рис. 2
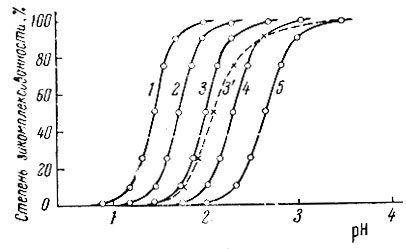
Рис. 1. Зависимость степени закомплексованности индикаторных количеств лантана ЭДТА от значения pH. Концентрация ЭДТА: 1 - 1; 2 - 0,1; 3 - 0,01; - 0,001; 5 - 0,0001 М; 3 - концентрация лантана и комплексообразующего реагента 1 М
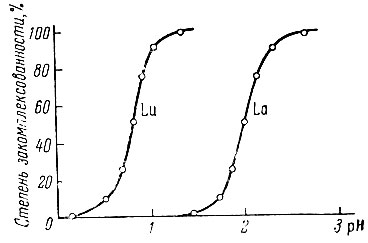
Рис. 2. Пределы комплексообразования рзэ с ЭДТА при концентрации ее 0,01 М
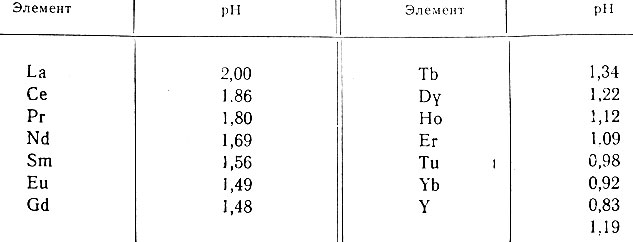
Таблица 2. Значение pH, при котором 50% рзэ закомплексовано 10-2 М раствором ЭДТА
В среднем различие величины pH для двух соседних рзэ не превышает 0,1 единицы pH.
Рзэ и комплексообразующий реагент присутствуют в сравнимых количествах. Долю закомплексованного металла в этом случае находят из двух уравнений:
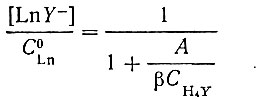 (13)
(13)и
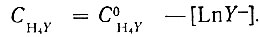
На рис. 1 для сравнения нанесена кривая 3' комплексования лантана для молярного отношения [La] : [Н4Y], равного единице.
Как видно, при увеличении концентрации металла область комплексования лантана ЭДТА сдвигается в сторону больших значений pH.
Распределение рзэ в системе двух несмешивающихся растворителей в присутствии комплексообразующего реагента
Рассматривая равновесия в системе двух несмешивающихся растворителей, мы исходили из следующего: все рзэ, незакомплексованные ЭДТА, практически находятся в органической фазе, т. е. коэффициенты распределения нитратов рзэ Кd > 20; закомплексованные рзэ не экстрагируются; рзэ вводят в систему, как правило, с органической фазой. Концентрация металла в системе выражается уравнением:
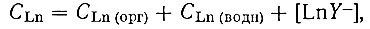 (14)
(14)где CLn(водн) - концентрация незакомплексованных ЭДТА форм металла.
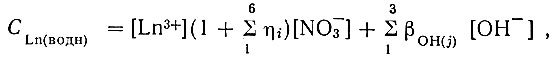 (15)
(15)откуда
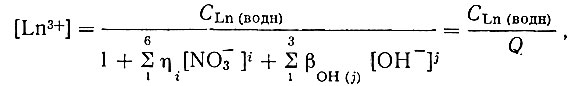 (16)
(16)где
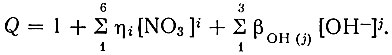
Коэффициент распределения незакомплексованных ЭДТА форм рзэ равен
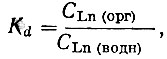 (17)
(17)откуда
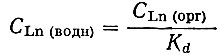
Наблюдаемый коэффициент распределения рзэ в присутствии ЭДТА равен
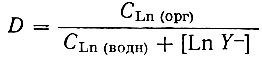 (18)
(18)или с учетом уравнений (5), (15), (16) и (17):
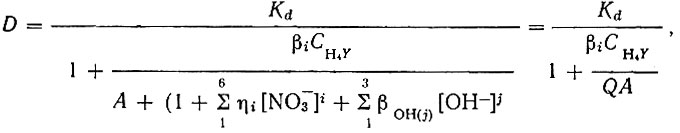 (19)
(19)где CH4Y = [Y4-]A - концентрация свободной Н4Y, не связанной в комплексные соединения.
Частные случаи распределения рзэ в системе двух несмешивающихся растворителей в присутствии эдта
Рзэ присутствуют в индикаторных количествах, комплексообразователь находится в избытке, нитраты рзэ полностью диссоциированы.
Тогда уравнение (19) для коэффициента распределения D примет такой вид
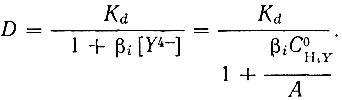 (20)
(20)Аналогичное уравнение было предложено Михайловым [25].
Анализ этого уравнения показывает, что
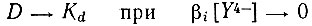
и

На рис. 3 приведены кривые извлечения рзэ, полученные экс- и расчетным путем по формуле (20). Экспериментальные и расчетные данные хорошо совпадают, за исключением тулия (пунктирная кривая). Несовпадение для тулия скорее всего связано с отсутствием точных значений константы комплексообразования тулия с ЭДТА. Аналогичный ход зависимости степени извлечения рзэ от pH наблюдается и для других реагентов, например для 1, 2-диаминциклогексатетрауксусной кислоты (рис. 4).
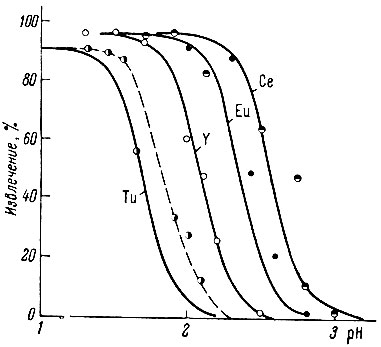
Рис. 3. Извлечение индикаторных количеств Tu, Y, Се и Еu в присутствии избытка ЭДТА при экстракции ТБФ
Для практических расчетов формулу (20) можно упростить. При распределении рзэ в условиях, когда Кd ≥ 20, можно пренебречь единицей в знаменателе, так как разница в значениях степеней извлечения рзэ, найденных по упрощенной формуле и формуле (20), не превышает нескольких процентов даже при величинах βi[Y4-], близких к единице. Тогда
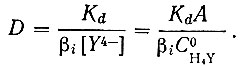 (21)
(21)При распределении нескольких компонентов фактор разделения φ равен:
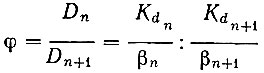 (22)
(22)или для n компонентов:
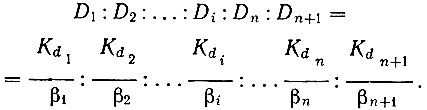 (23)
(23)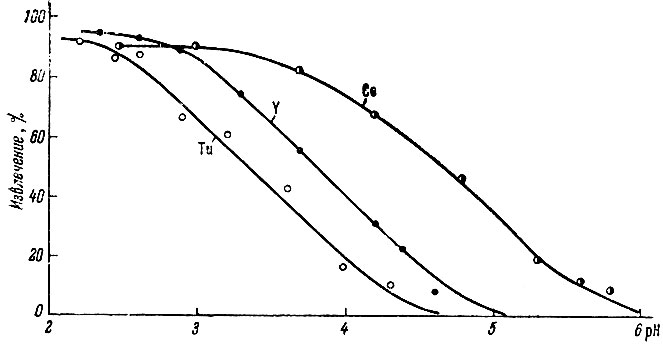
Рис. 4. Извлечение индикаторных количеств Tu, Y, Се в присутствии избытка ЭДТА при экстракции ТБФ
Рзэ присутствуют в сравнимых количествах, гидролиз отсутствует, концентрация нитрат-иона 5-8 М. В этом случае следует учитывать комплексообразование рзэ с нитрат-ионом. Тогда упрощенная формула для коэффициента распределения D будет иметь следующий вид:
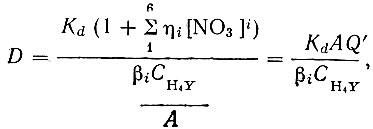 (24)
(24)где
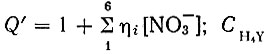
СH4Y - концентрация не закомплексованных форм ЭДТА, равная
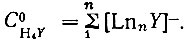
На рис. 5 приведена кривая извлечения церия, полученная при соотношении [Ln]: [Н4Y] =1:1. Эта кривая распределения несколько растянута при высоких значениях pH, что находится в полном соответствии с аналогичной кривой комплексообразования лантана, приведенной на рис. 1 (см. кривую 3).
![Рис. 5. Извлечение церия при экстракции ТБФ в присутствии ЭДТА. Соотношение [ЭДТА] : La = 1 : 1; концентрация La - 0,1 М](pic/000465.jpg)
Рис. 5. Извлечение церия при экстракции ТБФ в присутствии ЭДТА. Соотношение [ЭДТА] : La = 1 : 1; концентрация La - 0,1 М
Из формулы (24) следует, что в зависимости от величины Q' область комплексообразования рзэ с ЭДТА сдвигается в ту или иную сторону значений pH. Фактор разделения рзэ в соответствии с формулой (24) выражается следующим образом:
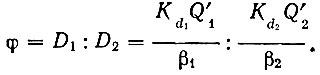 (25)
(25)В тех условиях, где значения Q' для различных рзэ мало отличаются друг от друга (например в областях, близких к точке инверсии), фактор разделения будет равен
Ка
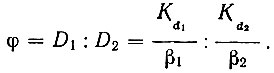 (26)
(26)Для расчета распределения рзэ в присутствии ЭДТА в зависимости от pH водной фазы необходимо решить систему двух уравнений:
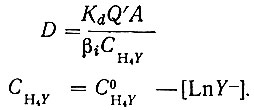
В том случае, если присутствует п компонентов и соблюдаются следующие условия: рзэ присутствуют в избытке, pH раствора поддерживается таким, что ЭДТА в водной фазе полностью связана с рзэ (т. е. pH > 4, Кd > 20), расчеты значительно упрощаются.
Коэффициент распределения i-того компонента для этих условий равен
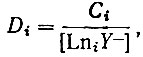 (27)
(27)где Ci - равновесная концентрация металла в органической фазе.
В условиях полного связывания ЭДТА
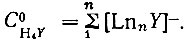 (28)
(28)Доля закомплексованной формы рзэ с учетом уравнения (27) равна:
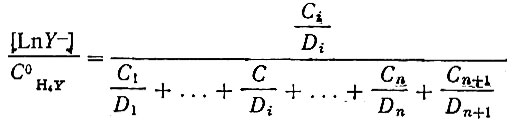 (29)
(29)или, применяя уравнение (24),
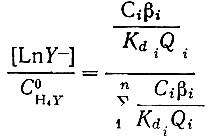 (30)
(30)В частном случае, если присутствуют два компонента и известны исходные концентрации в органической фазе С01 и С02, можно рассчитать
их концентрацию в водной фазе. Коэффициенты распределения компонентов выражаются следующими уравнениями:
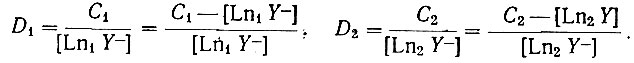 (31)
(31)
Обозначим 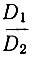 - через φ, тогда:
- через φ, тогда:
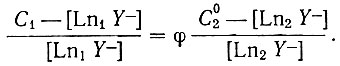 (32)
(32)Концентрация ЭДТА равна:
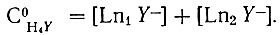 (33)
(33)Обозначим [Ln1 Y-] через X, тогда:
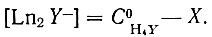 (34)
(34)Решая совместно уравнения (22) и (23) с учетом уравнения (24), получим:
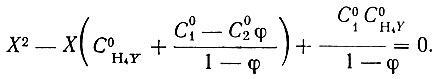 (35)
(35)Экстракционное разделение рзэ в присутствии комплексообразующих лигандов
Следует отметить, что органический растворитель закомплексовывает рзэ, причем фактор разделения нитратов рзэ при использовании некоторых растворителей может доходить до 2-2,5 [4, 5, 26, 27]. В этом случае действие органического растворителя и комплексообразующего агента, находящегося в водной фазе, будет противоположно. Поэтому для разделения должны выбираться такие растворители (или создаваться такие условия), когда экстрагируется 'вся сумма рзэ практически без разделения, либо экстракция должна. Проводиться в области инверсии, в которой коэффициенты распределения более легких рзэ имеют большие значения, чем коэффициенты распределения более тяжелых элементов [5, 28].
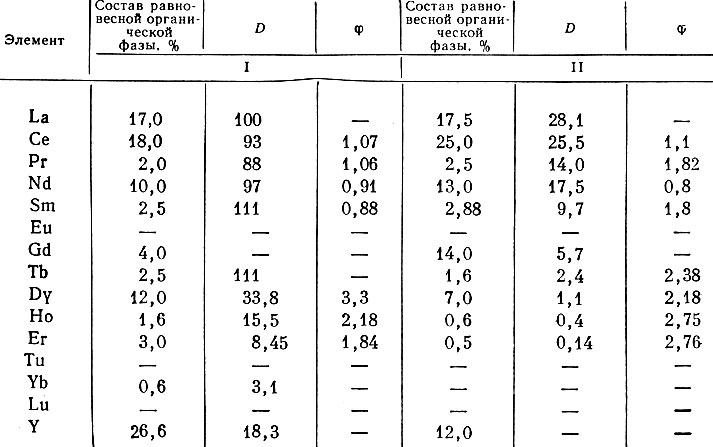
Таблица 3. Значения коэффициентов распределения и факторов разделения рзэ при экстракции ДАМФК в присутствии ЭДТА (pH 4-4,5). Состав исходной органической фазы: 100% ДАМФК, 70 г Ln2O3/л. Состав исходной водной фазы:- I. 0,01 М ЭДТА, 3 М LiNO3. II. 0,05 М ЭДТА, ЗМ LiNO3
![Рис. 6. Зависимость степени обогащения рзэ от значения атомного номера при экстракции ТБФ в присутствии ЭДТА. Концентрация NHO4,3 - 800 г/л; рН 2; концентрация рзэ - 100 г LnO2,3 /л. [ЭДТА] : [Er, Tu, Yb, Lu] = 1,5](pic/000480.jpg)
Рис. 6. Зависимость степени обогащения рзэ от значения атомного номера при экстракции ТБФ в присутствии ЭДТА. Концентрация NH4NO3 - 800 г/л; рН 2; концентрация рзэ - 100 г Ln2O3 /л. [ЭДТА] : [Er, Tu, Yb, Lu] = 1,5
Применение предлагаемых нами комплексообразующих агентов должно быть особенно перспективным для разделения рзэ иттриевой подгруппы, у которых при экстракции различными органическими растворителями (средние фосфаты и другие) инверсия сохраняется в довольно широкой области концентраций нитрат-иона (4,5-5 М).
При экстракции рзэ цериевой подгруппы инверсия значений коэффициентов распределения сохраняется лишь в узком интервале концентраций нитрат-иона [5]. Точка инверсии при экстракции ТБФ, ДАМФК соответствует 0,4-0,5 М концентрации нитрат-иона.
При столь низких значениях концентрации нитрат-иона такие растворители, как ТБФ, ДАМФК, дают низкие значения коэффициентов распределения нитратов рзэ и (поэтому не могут быть использованы для разделения цериевых элементов в присутствии Рис. 6. Зависимость степени обогащения комплексообразующих реагентов. Для рзэ от значения атомного номера при их разделения нужны такие растворители, для которых коэффициенты распределения нитратов рзэ цериевой концентрация рзэ подгруппы будут болыне 20 в области инверсии (однако следует думать, что с увеличением экстракционной силы растворителей область инверсии будет сдвигаться в сторону все меньших концентраций нитрат-иона).
На рис. 6 и в табл. 3 представлены данные, указывающие на возможность эффективного разделения рзэ иттриевой подгруппы в области инверсии при экстракции ДАМФК.
Для наглядности на рис. 3 нанесены значения коэффициента распределения рзэ, полученные в тех же условиях, но в отсутствие ЭДТА.
Из табл. 3 следует, что в присутствии ЭДТА в водном растворе коэффициенты распределения уменьшаются от лантана к лютецию в порядке возрастания прочности комплексных соединений рзэ с ЭДТА. При этом фактор разделения ср двух соседних элементов увеличивается по мере возрастания атомного номера, достигая у иттриевых элементов величины 2,5-2,7 (значительно выше, чем для большинства известных экстракционных систем).
Большая величина фактора разделения иттриевых земель обусловлена наложением двух явлений: инверсии коэффициентов распределения и комплексообразования. Для элементов цериевой подгруппы, где увеличение коэффициентов распределения и констант устойчивости комплексных соединений -проходит в одном направлении, величина фактора разделения очень мала, и разделение невозможно.
На рис. 6 показано экстракционное обогащение рзэ в присутствии ЭДТА и нанесены значения коэффициентов распределения рзэ, полученные в тех же условиях, но в отсутствие ЭДТА. Степень обогащения рзэ з водной фазе возрастает в области инверсии значений коэффициентов распределения (рзэ иттриевой подгруппы).
Разделение рзэ в присутствии комплексообразующих агентов можно проводить в основном двумя методами [29].
1. Экстракцию проводят в области комплексообразования рзэ (pH 1,5 - 3) при определенных значениях pH водной фазы. Меняя значения pH раствора (или в конечном итоге концентрацию свободного лиганда), можно разделять рзэ. Однако в этом случае нужно очень точно поддерживать заданное pH, так как в среднем различие величины pH комплексообразования для двух соседних рзэ не превышает 0,1 pH.
2. Разделение проводят при pH ∼ 3,5, когда все рзэ практически пол-j ностью закомплексованы ЭДТА. При недостатке ЭДТА рзэ из органической фазы будут переходить в водную фазу в соответствии с их константами устойчивости и концентрациями [см. уравнение (30)]. Возможны два способа выполнения процесса разделения.
В случае первого (назовем его прямым) в органическую фазу рзэ вводят в количестве, превышающем содержание лиганда в водной фазе.
При втором способе (обратном или вытеснительном) "недостаток" лиганда создается за счет того, что в систему вводят ионы, образующие с ЭДТА более прочные соединения, чем рзэ (например ионы Zn, Fe (III), Си, Ni).
В этом случае рзэ, связанные ЭДТА, находятся первоначально в водной фазе (при отношении молярных концентраций 1:1). При введении перечисленных ионов происходит вытеснение рзэ из соединений и пере-ход их в органическую фазу в соответствии с константами устойчивости. Действие вытеснителя будет эффективно лишь в том случае, если его константа устойчивости больше константы устойчивости крайнего рзэ в разделяемой смеси. Расчет вытеснительного метода разделения рзэ не представляет особых затруднений. Достаточно лишь в приведенных выше соответствующих уравнениях добавить член, учитывающий связывание ЭДТА с ионом-вытеснителем.
Для иллюстрации изложенного приведены экспериментальные данные о распределении рзэ в системах с комплексообразующим реагентом, полученные в различных условиях.
Разделение иттр и я и иттербия. Отношение молярных концентраций элементов 1:1. Опыты проводили в системе: раствор нитратов рзэ в 100%-ном ДАМФК - водный раствор, содержащий 3 М LiNO3, 0,04 М ЭДТА; pH раствора 4. Для стабилизации величины pH в водный раствор был введен La(NO3)3 в стехиометрическом с комплексообразующим лигандом количестве. При этом pH раствора даже в начале процесса практически не менялось.
Присутствие лантана не сказывается на разделении иттриевых земель. Отделение лантана также не представляет трудностей, так как коэффициенты распределения лантана и рзэ иттриевой подгруппы отличаются примерно на два порядка. Приводим данные о распределении иттрия и иттербия при недостатке комплексообразующего реагента:

Как следует из приведенных экспериментальных данных, даже за одну ступень экстракции можно получить фракцию иттербия с примерна 15-кратным обогащением по отношению к иттрию.
Для получения концентрата тяжелых рзэ иттриевой группы была использована полупротивоточная 50-ступенчатая экстракционная установка. В ячейки был налит водный раствор 6 М LiN3 и ЭДТА. Равновесное pH водной фазы равнялось 4,5. Через установку был пропущен ТБФ, содержащий около 100 г Ln2O3/л. Состав экстракта и объединенных водных фаз следующий:

Как видно из приведенных данных, водная фаза представляет концентрат тяжелых рзэ: Er, Tu, Yb и Lu с небольшой примесью Y.
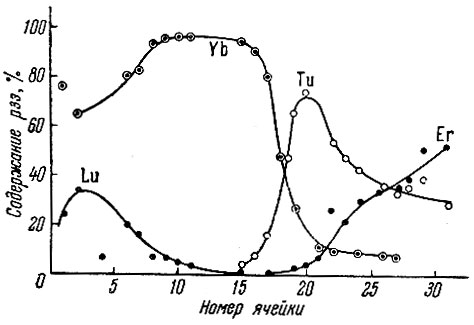
Рис. 7. Процентное содержание рзэ в ячейках 50-ступенчатой экстракционной установки при экстракции ТБФ в присутствии ЭДТА. Концентрация рзэ - 100 г Ln2O3/л; pH 4,5
Анализ проб водных фаз, отобранных из отдельных ячеек, показал, что даже в условиях простого распределения рзэ в присутствии только комплексообразующего реагента без вытеснителя можно добиться значительного обогащения рзэ (рис. 7): так, в отдельных ячейках содержание Yb, Er, Tu по сравнению с исходным раствором возрастает в 38; 36 и 250 раз соответственно.
Рзэ экстрагировали в присутствии вытеснителя - меди. Наглядно процесс последовательного вытеснения медью представлен в табл. 4 и на рис. 8. Водная фаза содержала 20 г Ln2O3 на 1 л; 8 М LiNO3 и ЭДТА.
Растворитель ТБФ; исходный состав концентрата рзэ (в %): La - 6,7; Се - 13,5; Рr - 1,6; Nd - 50; Sm - 1,4; Gd - 7,5; Tb - 0,2; Dy - 3,9; Ho - 1,3; Er - 2,4; Tu - 0,15; Yb - 1,1; Lu - 0,15; Y - 46.
В табл. 4 приведены также величины коэффициентов распределения, факторов разделения и процентное содержание Y и Tu в водном растворе.
![Таблица 4. Экстракционное распределение иттрия и тулия в присутствии различных количеств нитрата меди (pH 3,5) [ЭДТА]: [рзэ] - 1,2: 1](pic/000484.jpg)
Таблица 4. Экстракционное распределение иттрия и тулия в присутствии различных количеств нитрата меди (pH 3,5) [ЭДТА]: [рзэ] - 1,2: 1
Для проведения анализа в исходный раствор были введены радиоактивные изотопы Y91 и Tu170.
Из приведенных данных следует, что даже за одну ступень экстракции можно получить фракцию тулия, практически не содержащую иттрия.
![Рис. 8. Кривые распределения Y и Tu, полученные при экстракции ТБД в присутствии ЭДТА в процессе вытеснения их медью. Концентрация рзэ - 20 г LnO2,3/л; pH 3,5; [рзэ] : [ЭДТА] = 1 : 1,2](pic/000485.jpg)
Рис. 8. Кривые распределения Y и Tu, полученные при экстракции ТБД в присутствии ЭДТА в процессе вытеснения их медью. Концентрация рзэ - 20 г Ln2O3/л; pH 3,5; [рзэ] : [ЭДТА] = 1 : 1,2
Величина фактора разделения, полученная в опыте, показывает, что в данной системе проявляется максимальное различие в свойствах рзэ иттриевой подгруппы.
Более эффективный вытеснитель - железо. Распределение рзэ проводили с тем же концентратом рзэ и в тех же условиях, что и в предыдущем примере, только в качестве вытеснителя использовали нитрат железа.
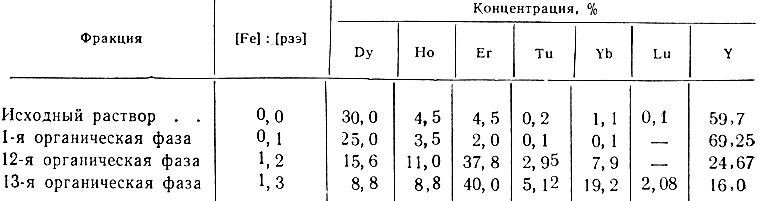
Таблица 5. Состав некоторых равновесных фаз, получающихся в процессе вытеснения рзэ, ионом железа
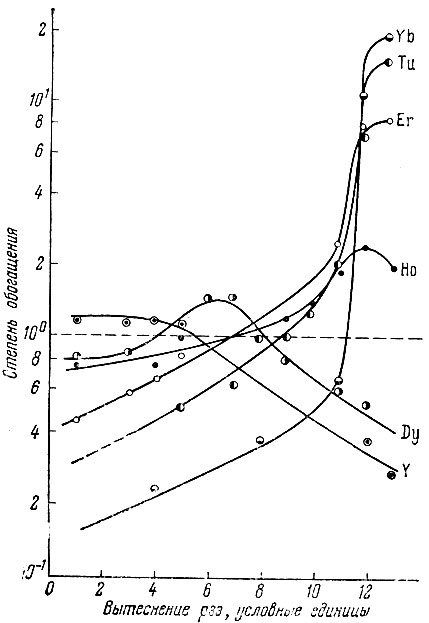
Рис. 9. Обогащение рзэ, наблюдаемое в процессе вытеснения ионом железа, в системе ДАМФК, 3 М LiNO3, 0,3 М ЭДТА, 0,1 М рзэ (pH 3)
Как следует из данных, приведенных в табл. 5 и на рис. 9, при использовании в качестве вытеснителя железа можно добиться высокого обогащения тяжелых иттриевых элементов и в конечное итоге полного разделения всех элементов иттриевой группы. Степень обогащения тяжелых элементов иттриевой группы пропорциональна их порядковому номеру (в полном соответствии с величинами констант устойчивости) .
При использовании железа в качестве вытеснителя процесс разделения рзэ на многоступенчатых экстракционных установках значительно упрощается. Нитрат железа можно вводить в систему с органическим растворителем, а не подавать водный раствор его в каждую ячейку. Для этого следует выбирать такие системы, в которых коэффициент распределения Fe(NO3)3 не менее единицы. Например, в системе 100%-ный ДАМФК - 0,2 М [раствор Fe(NO3)3 в 5 М LiNO3 коэффициент распределения железа равен 2,4. В системе 0,5 М раствор трибутилфосфиноксида в ДАМФК - 0,2 М раствор Fe(NO3)3 в 3 М LiNO3 железо экстрагируется с коэффициентом распределения 7,4. В указанных системах сохраняется инверсия в распределении рзэ иттриевой группы.
Полученные данные о распределении рзэ в присутствии комплексообразующих агентов, растворимых в водной фазе, открывают новые возможности экстракционного разделения рзэ иттриевой группы.
Литература
- J. Collopy, J. F. Blum. J. Phys. Chem., 64, 1325 (1960).
- А. С. Соловкин, М. И. Конарев, Д. П. Адаев. ЖНХ, 5, 1861 (1960).
- В. Б. Шевченко, В. С. С мелов. Атомная энергия, 6, 140 (1959).
- Н. Е. Брежнева, В. И. Левин, Г. В. Корпусов, Е. Н. Патрушева. Радиохимия (в печати).
- Е. Неsfоrd, Е. Е. Jackson, Н. А. С. Мс Кау. J. Inorg. Nucl. Chem., 9, 273 (1959).
- D. Dyrssen, G. Dahlberg. Acta Chem. Scand., 7, 868 (1953).
- М. Г. Панова, В. И. Левин, Н. Е. Брежнева. Радиохимия, 2, 197 (1960).
- D. Dyrssen. Svensk. kem. tidskr., 66, 234 (1954).
- N. Furman, W. Mason, J. Pekola. Anal. Chem., 21, 1325 (1949).
- V. Auger, L. Lafontane, V. Gaspar. Compt. rend., 170, 995 (1929).
- В. М. Вдовенко, A. H. Лазарев. ЖНХ, 3, 155 (1957).
- Th. Mоeller, D. E. Jaсksоn. Anal. Chem., 22, 1393 (1950).
- Th. Moeller. Record Chem. Progress, 14, 69 (1953).
- Т. K. Keenan. J. Am. Chem. Soc., 16, 2182, 2184 (1954).
- Г. Т. Сиборг, Д. Д. Кац. Химия актинидных элементов. Перевод с англ. под ред. В. К. Дедова. М., Атомиздат, 1960.
- G. Morrison, Н. Frеisеr. Solvent extraction in analitical chemistry. N. Y., 1957.
- L. L. Byrger. J. Phys. Chem., 62, 590 (1958).
- E. H. Патрушева, H. E. Брежнева, Г. В. Корпусов. Радиохимия (в печати).
- Е. I. Wheel rig, F. Н. Sреdding. J. Am. Chem. Soc., 25, 2529 (1953).
- J. K. March. J. Chem. Soc., 1950, 1819; 1951, 1461; 1952, 4804.
- R. C. Vickery. J. Chem. Soc., 1951, 1817; 1952, 4357; 1954, 1181.
- Г. Шварценбах. Комплексонометрия. М., Госхимиздат, 1958.
- G. Schwarzenbach, H. Ackerman. Helv. chim. acta, 30, 1799 (1947).
- G. Schwarzenbach, J. Heller. Helv. chim. acta, 34, 576 (1951).
- В. М. Михайлов, В. Г. Торгов, Н. Ф. Мелехина. ЖНХ, 6, 1460 (1961).
- Е. Н. Патрушева, Н. Е. Брежнева, Г. В. Корпусов. Радиохимия, 2* 541 (1960).
- D. F. Peppard, J. Fаris, P. R. Gray, G. М. Masоn. J. Phys. Chem., 57,^ 294 (1953).
- Г. В. Корпусов, И. В. Ескевич, Е. Н. Патрушева, В. В. Ергенков, Л. Р. Алексеева. Сб.: "Экстракция". М., Атомиздат, 1962, стр. 117.
- Г. В. Корпусов, В. Ф. Ескевич, Е. Н. Патрушева. Авторское свидетельство 135646, 7 апреля 1960 г.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'