
Флуоресцентная реакция скандия с 8-оксихинолином (Д.П. Щербов, А.Х. Ловчи)
Сумма рзэ, выделяемая при анализе ряда природных объектов, может содержать скандий, определение которого до настоящего времени представляет значительные трудности. Экстракционно-фотометрические методы с применением 8-оксихинолина были описаны для открытия или определения Al [1], Be [2], Ga и In [3], Li [4], Sn [5], Y [6], Zn [7], Zr [2] в некоторых рзэ [8]. Полуколичественное визуальное изучение флуоресценции оксихинолинатов ряда металлов выполнили Коренман и Авро- ва [9], но аналитическое применение ее авторами не описано.
Цель данной работы - систематически и количественно изучить флуоресценцию растворов оксихинолинатов различных элементов в органических растворителях и выяснить возможность использования ее для определения скандия в осадке суммы рзэ.
Экспериментальная часть
Техника работы
1 мл раствора с определенным содержанием испытуемого вещества нейтрализовали по индикатору, добавляли 2 мл буферного раствора с заданным значением pH (см. ниже) и 0,1 мл 5%-ного спиртового раствора 8-оксихинолина. Раствор перемешивали, приливали 5 мл хлороформа и встряхивали 1 мин. Холостые опыты проводили в таком же порядке. После разделения слоев яркость свечения экстракта измеряли на упрощенном флуориметре с фотоумножителем ФЭУ-19 и осветителем с лампой накаливания [10, И]. Результаты измерения яркости флуоресценции выражали в микроамперах фототока или в виде относительной чувствительности - отношения яркости свечения испытуемого раствора к флуоресценции холостого опыта [12].
Спектры поглощения флуоресценции
Для выбора наилучших условий измерения флуоресценции* были сняты спектры поглощения и излучения оксихинолинатов Al, Ga и In, экстрагированных при pH 5, и оксихинолината скандия, извлеченного из водного слоя при pH 7. Для устранения поглощения или свечения свободного оксихинолина в этих опытах брали избыток исследуемого элемента (по 200 мкг) и уменьшенное количество оксихинолина (0,2 мл 0,5%-ного раствора). Спектры поглощения снимали на спектрофотометре СФ-4, спектры флуоресценции - на том же приборе с соответствующими приставками [13, 14]. Результаты этих опытов представлены на рис. 1. Растворы оксихинолинатов имеют широкие полосы поглощения с максимумом у большинства из них около 390 ммк; но значительная часть каждой полосы расположена в видимой области спектра. Следовательно, флуоресценцию целесообразно возбуждать не ультрафиолетовой линией Hg λ = 366 ммк, а источником света со сплошным спектром испускания [15].
* (Предварительными опытами было установлено, что оксихинолинаты этих элементов интенсивно флуоресцируют при выбранных значениях pH.)
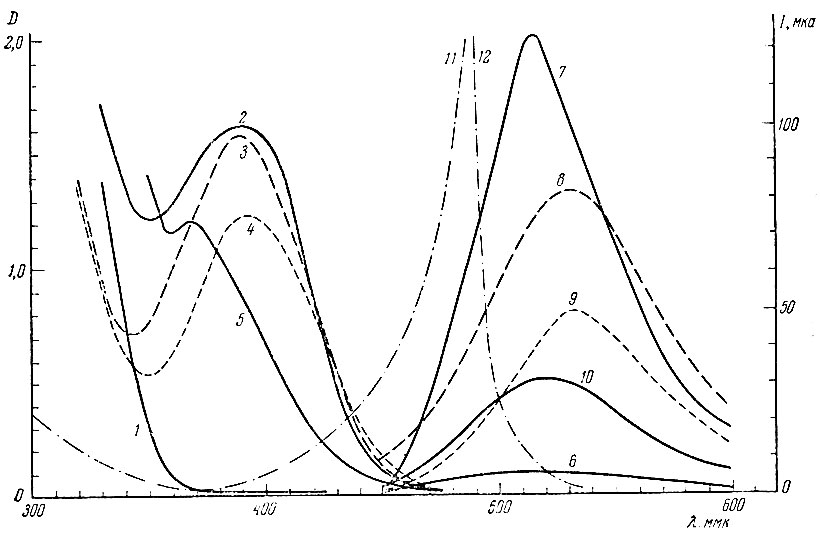
Рис. 1. Спектры поглощения и флоуресценции растворов некоторых оксихинолинатов. Поглощение: 1 - холостой опыт; 2 - алюминий; 3 - галлий; 4 - индий; 5 - скандий. Флуоресценция; 6 - холостой опыт; 7 - алюминий (его координаты уменьшены в два раза); 8 - галлий; 9- индий; 10 - скандий. Пропускание светофильтров: 11 - первичного(стекло ФС-6); 12 - вторичного (стекло ЖС-18)
Исходя из спектральных кривых рис. 1, для флуориметрирования на приборе с лампой накаливания было испытано несколько пар скрещенных светофильтров: первичных ультрафиолетовых и фиолетовых и вторичных оранжевых и желтых. Наибольшая чувствительность (абсолютная и относительная) была достигнута при использовании первичного светофильтра из фиолетового стекла ФС-6 и вторичного - из желтого стекла ЖС-18 [16]; эту скрещенную пару и применяли в дальнейшей работе.
Интенсивность флуоресценции
В указанных условиях была измерена интенсивность флуоресценции растворов оксихинолинатов 60 элементов, взятых по 10 мкг. Растворы их нейтрализовали по бумаге конго красный и затем добавляли буферные растворы (pH 3, 5, 7 или 9) [17]. Эти опыты показали, что за немногими исключениями, с возрастанием pH увеличивается как число флуоресцирующих оксихинолинатов, так и интенсивность их свечения. При pH 3 и 5 флуоресценция растворов скандия слаба, при pH 9 начинают флуоресцировать многие из рзэ. Поэтому мы остановились на pH 7. Результаты измерения свечения при этой кислотности среды показаны на рис.. 2 (интенсивность флуоресценции за (вычетом холостого опыта выражена в относительных единицах, показывающих, во сколько раз она превышает свечение холостого опыта). Наиболее интенсивно флуоресцирует Аl, менее сильно - Ga, In, Sc и Sb, слабое свечение наблюдается у Ве Y, La, Eu, Си, Zn, Ти и Hg.
Флуоресцентная реакция скандия была исследована более подробно. Для нейтрализации его растворов перед прибавлением буферной смеси были испытаны индикаторы бромкрезоловый пурпурный, бромфеноловый синий, метиловый оранжевый, нейтральный красный, феноловый красный и индикаторная бумага (Хемапол) для интервала pH 7,3-8,8. Наиболее воспроизводимые результаты были достигнуты при использовании метилового оранжевого. При сравнении экстракции оксихинолината изоамиловым спиртом, н.бутанолом, хлороформом и четыреххлористым углеродом наиболее интенсивное свечение, устойчивое в течение более суток, и наибольшая величина отношения флуоресценции скандия к свечению холостого опыта были получены с хлороформом. С этим растворителем, при нейтрализации по метиловому оранжевому, был построен калибровочный график для определения скандия в пределах от 1 до 40 мкг в объеме 5 мл экстрагента. Прямолинейная зависимость яркости флуоресценции от концентрации наблюдается в пределах от 1 до 30 мкг Sc.
Влияние различных ионов на флуоресценцию скандия
Для выяснения влияния других элементов на флуоресценцию оксихинолината скандия к растворам, содержавшим по 10 мкг Sc, прибавляли по 100 мкг одного из сорока наиболее распространенных элементов. Результаты этих опытов также показаны на рис. 2. Как видно, очень многие ионы ослабляют флуоресценцию скандия, поэтому без предварительных разделений анализ выполнить нельзя.
Для уточнения влияния суммы рзэ была приготовлена смесь в соотношении, соответствующем их среднему содержанию в земной коре [18] (с общим содержанием их суммы 1 мг/мл). Для проведения опытов брали 5 или 10 мкг Sc и 100 или 500 мкг суммы рзэ. Результаты измерения интенсивности свечения (в мка) приведены в табл. 1. Эти данные показывают, что присутствие 100 мкг суммы рзэ не оказывают влияния на флуоресценцию раствора скандия, а 500 мкг повышают ее интенсивность, так как при таком содержании сами рзэ вызывают появление некоторой флуоресценции.
Для выяснения возможности маскирования скандия или суммы рзэ путем комплексообразования было испытано влияние фторидов, фосфатов, пирофосфатов, оксалатов, тартратов, цитратов и трилона Б. При проведении реакции в раствор, содержащий 10 мкг Sc; или 100 мкг Yr либо 500 мкг суммы рзэ, вводили по 1 мл 1%-ного раствора испытуемого комплексообразующего агента и остальные требуемые реагенты и флуориметрировали обычным путем. Эти опыты показали, что пирофосфат и трилон Б маскируют все испытанные элементы. Фосфат-, оксалат-, тартрат- и цитрат-ионы мало влияют на иттрий, но снижают свечение оксихинолинатов скандия и суммы рзэ. Фторид не влияет на флуоресценцию иттрия и суммы рзэ, но почти полностью гасит флуоресценцию оксихинолината скандия.
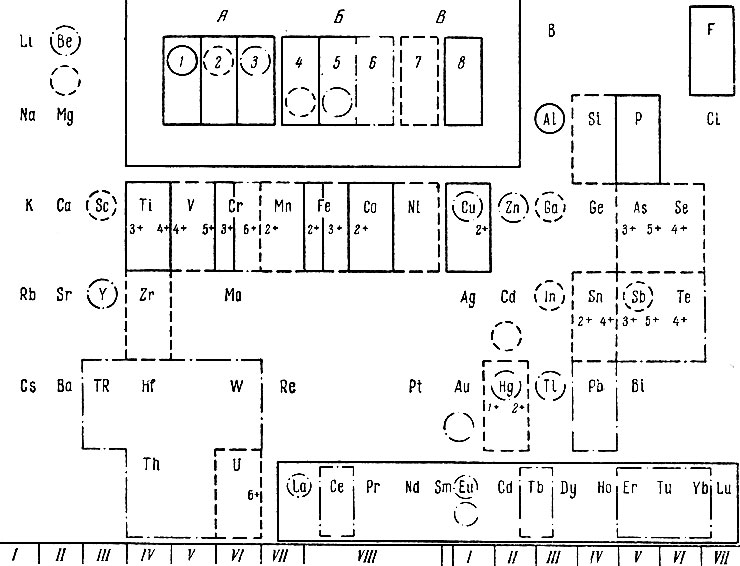
Рис. 2. Флуоресценция растворов оксихинолинатов различных ионов и их влияние на свечение оксихинолината скандия. А - 10 мкг металла вызывает свечение, которое ярче флуоресценции пробы холостого опыта: 1 - в 30 раз; 2 - в 5-10 раз; 3 - в 0,5-1,5 раза (см. текст); Б -100 мкг элемента флуоресцируют: 4 - ярче 2 мкг Sc; 5 - слабее 1,5 мкг Sc; В - 100 мкг элемента ослабляют свечение 10 мкг Sc: 6 - на 10-30%; 7 - на 40-80%; 8 - на 85-95%
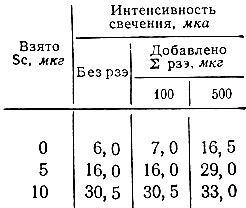
Таблица 1. Влияние суммы рзэ на флоуресценцию раствора оксихинолината скандия
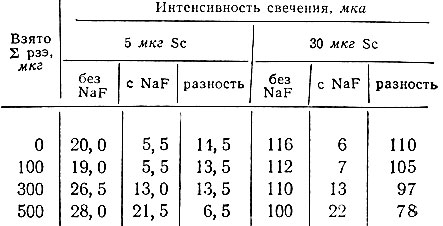
Таблица 2. Влияние NaF на интенсивность свечения смесей оксихинолинатов скандия и суммы рзэ
Это свойство фторида может быть использовано для определения скандия в присутствии суммы рзэ следующим путем: в одной части анализируемого раствора можно измерять суммарную флуоресценцию скандия и суммы рзэ, в другой, после добавления фторида - свечение одних рзэ, и по разности обоих измерений определять скандий. Для проверки этой возможности было испытано влияние фтор-иона на свечение оксихинолината скандия в присутствии суммы рзэ. Для опытов брали 5 и 30 мкг Sc, от 100 до 500 мкг суммы рзэ и 10 мг NaF. Результаты измерения флуоресценции этих растворов приведены в табл. 2. Как видно, при содержании суммы рзэ > 300 мкг интенсивность свечения оксихинолината скандия понижается. При содержании же рзэ < 300 мкг (10-60-кратный избыток по отношению к скандию) они не влияют на вычисленное по разности свечение оксихинолината скандия; это дает возможность разработать методики его количественного определения в осадке суммы рзэ.
Литература
- Е. Goon, J. Е. Pet ley, W. Н. Me Mullen, S. S. Wiberley. Anal. Chem., 25, 608 (1953).
- H. Goto. Sci. Repts. Tohoku Imp. Univ., 29, 287 (1940); C. A., 35, 1722 (1941).
- С. Д. Гурьев, JI. Б. Гинзбург, А. П. Шибapeнкова. Сборник трудов ГИНЦВЕТМЕТа, № 10. М., Металлургиздат, 1955, стр. 387. '
- С. Е. White, М. Н. Fletcher J. Parks. Anal. Chem., 23, 478 (1951).
- JI. Б. Гинзбург, Э. П. Шкробот. Зав. лаб., 23, 527 (1957).
- М. Ishibashi, Т. Shigematsu, Y. Nischkawa. J. Chem. Soc. Japan, Pure Chem. Sec., 77, 1474, 1479 (1956).
- L. L. Merrit. Ind. Eng. Chem., Anal. Ed., 16, 758 (1944).
- F. H. Pоllard, J. F. W. McOmie, H. M. Stevens. J. Chem. Soc., 1954, 3435.
- И. М. Коренман, H. Ф. Авpова. Тр. по химии и хим. технологии (г. Горький), 1, 138 (1958).
- Д. П. Щербов, А. И. Пономаренко. Зав. лаб., 26, 1143 (1960).
- Д. П. Щербов, А. И. Пономаренко. Бюлл. ОНТИ Министерства геологии и охраны недр СССР, № 3, 83 (1961).
- Д. П. Щербов. Тр. Казахск. НИИ минерального сырья, № 5, 235 (1961).
- А. И. Пономаренко. Тр. Казахск. НИИ минерального сырья, № 3, 338 (1960).
- Д. П. Щербов, А. И. Пономаренко. Зав. лаб., 27, 1156 (1961).
- Д. П. Щербов, Р. Н. Коржева. Сб.: "Методы люминесцентного анализа". Минск, Изд-во АН БССР, 1960, стр. 43.
- Каталог цветного стекла. М., Оборонгиз, 1951.
- X. Т. С. Бриттон. Водородные ионы. Л., ОНТИ, 1936, стр. 209.
- Д. И. Рябчиков, Е. А. Терентьева, Ю. С. Скляренко. Тр. Комиссии по анал. химии, 3, 23 (1951).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'