
Примечания к гл. II
1 (В 1777 г. Пруст принял приглашение на кафедру химии и металлургии в только что основанной Королевской семинарии в городе Вергара (провинция Гипускоа) и проработал там по 1780 г., после чего вернулся в Париж.)
2 (В частности, лаборатория Пруста получила 46 кг сырой и 18,5 кг очищенной платины.)
3 (В то время (и много позже) считалось, что химическое сродство (причины или силы, побуждающие вещества вступать в химические реакции) всегда действует избирательно. Это значит, что если, например, на соединение АВ подействовать элементом С, сродство которого к элементу А больше, чем сродство последнего к элементу В, то реакция пойдет в сторону образования соединения АС и полного вытеснения элемента В. Ошибочность такого представления показал уже Бертолле, но оно было окончательно отвергнуто только в конце XIX в.)
4 (По словам Ж. Б. Дюма, "так вскоре начался между этими двумя великими противниками, столь достойными помериться силами, длительный научный спор, замечательный как талантом, так и хорошим вкусом его участников. И по форме, и по содержанию это один из прекраснейших образцов научной дискуссии" (Dumas J. Lecons sur la philosophic chimique. - Paris, 1837, p. 213).)
5 (В начале XX в. Н. С. Курнаков, изучая свойства двойных металлических сплавов в зависимости от состава, обнаружил существование в них химических соединений переменного состава и назвал их в память Бертолле бертоллидами (1912 г.). Долгое время считалось, что образование бертоллидов, иначе - нестехиометрических соединений, - явление редкое и свойственное только металлическим системам. Однако с развитием методов исследования оказалось, что-бертоллиды встречаются и среди других классов соединений - гидридов, карбидов, оксидов, сульфидов, силикатов, кристаллогидратов и др. (см. сб. "Нестехиометрические соединения". Пер. с англ.- М.: Химия, 1971). Термин "бертоллиды" для обозначения кристаллических соединений нестехиометрического состава официально принят Международным союзом теоретической и прикладной химии (ИЮПАК). См.: кн. Номенклатурные правила ИЮПАК по химии: Т. I. Неорганическая химия, физическая химия, аналитическая химия.- М.: 1979, с. 220, 230. Об истории проблемы бертоллидов. см.: Шептунова З. И. Химическое соединение и химический индивид.- М.: Наука, 1972.)
6 (В связи с этим Энгельс писал: "О том, как старые, удобные, приспособленные к прежней обычной практике методы переносятся в другие отрасли знания", где они оказываются тормозом: в химии - процентное вычисление состава тел, которое являлось самым подходящим методом для того, чтобы замаскировать - и которое действительно достаточно долго маскировало - закон постоянства состава и кратных отношений у соединений" [Маркс К., Энгельс Ф. Соч., т. 20". с. 608.].)
7 (О Прусте см.: Капустинский А. Ф. Жозеф Луи Пруст и открытие закона постоянства состава. Труды института истории естествознания и техники. Сборник. Т. 6. История химических наук и химической технологии.- М.: Изд-во АН СССР, 1955, с. 43-67; Джуа, с. 164-166, 172-185; Соловьев, 1971, с. 97-102; Соловьев, Т. 1, с. 108-112; Фигуровский, Т. 1, с. 432-437.)
8 (Числа проверены и исправлены по кн. Дальтон Дж. Сборник избранных работ по атомистике. Л.: Химтехиздат, 1940.)
9 (Еще в 1896 г. английские химики Г. Роско и А. Гарден в результате изучения архива Дальтона показали, что он установил закон кратных отношений не на основе экспериментальных данных, а исходя из положений атомной теории и только затем подтвердил его опытным путем. В настоящее время эта точка зрения общепринята.)
10 (Дальтон обозначал атомы элементов кружками, внутри которых вписаны либо точки и черточки, либо первые буквы английских названий элементов. Примеры: водород  , азот
, азот 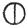 , углерод ●, кислород ○. Примеры формул: вода
, углерод ●, кислород ○. Примеры формул: вода  ○, оксид углерода ○●, диоксид углерода ○●○. Символы и формулы Дальтона,, не удобные для письма и типографского набора, вскоре были заменены буквенными и химическими знаками Берцелиуса (см. гл. III).)
○, оксид углерода ○●, диоксид углерода ○●○. Символы и формулы Дальтона,, не удобные для письма и типографского набора, вскоре были заменены буквенными и химическими знаками Берцелиуса (см. гл. III).)
11 (См. Маркс К., Энгельс Ф. Соч. т. 20, с. 131, 387-388.)
12 (О Дальтоне см.: Дальтон Дж. Сборник избранных работ по атомистике: Пер. с англ. / Редакция и примечания Б. М. Кедрова. Л., Химтехиздат, 1940; Кедров Б. М. Атомистика Дальтона.- М.- Л.: Химтехиздат, 1949; его же. Три аспекта атомистики. Учение Дальтона.- М.: Наука, 1969; Крицман В. А. Роберт Бойль, Джон Дальтон, Амедео Авогадро.- М.: Просвещение, 1978; Джуа, с. 166-177; Манолов. Т. I, с. 186-203; Мусабеков, Черняк, с. 80-85.)
13 (По решению Национального конвента в Париже 30 ноября 1794 г. была открыта Центральная школа общественных работ, задачей которой была подготовка военных и гражданских инженеров. 1 сентября 1795 г. она была преобразована в Политехническую школу -высшее учебное заведение с трехлетним курсом, дававшее солидную подготовку по математике, механике, физике и химии. Окончившие Политехническую школу поступали в профессиональные школы,, где получали высшее техническое образование по различным специальностям (горному делу, путям сообщения, артиллерии, фортификации и др.). Благодаря блестящему составу профессоров Политехническая школа много способствовала развитию физико-математических и химических наук. Ее первыми, питомцами были такие ученые, как Ж. М. Ампер, Д. Ф. Араго, Ж. Б. Био, Ж. Л. Гей-Люссак, О. Коши.)
14 (При Парижском ботаническом саду в период с 1789 по 1793 г. был создан Музей естественной истории - центральное научно-исследовательское учреждение для развития минералогии, ботаники, зоологии, химии и сельского хозяйства. В музее было 10 кафедр, заведующие которыми читали общедоступные лекции и вели научные работы.)
15 (В 1806 г. Гей-Люссак был избран членом Парижской Академии наук. Кроме того, он состоял членом многих других научных учреждений, в том числе иностранным почетным членом Петербургской Академии наук [избран 10 января 1830 г. (29 декабря 1829 г.)]. В 1832-1833 гг. он был членом палаты депутатов, а в 1839 г. получил звание пэра Франции.)
16 (В том же, 1802 г. Гей-Люссак (почти одновременно с Дальтоном и независимо от него) открыл носящий его имя закон, согласно которому коэффициент теплового расширения всех газов при постоянном внешнем давлении равен 0,00375/1 °С (современное значение 0,00367).)
17 (С современной точки зрения было бы правильнее сказать, что закон постоянства состава безусловно справедлив для газообразных соединений. Но его применимость к твердым (кристаллическим) соединениям ограничена вследствие существования бертоллидов (см. примечание5).)
18 (Полет Гей-Люссака и Био состоялся 2 августа 1804 г. Незадолго до этого, 12 июля (30 июня) 1804 г., академик-химик Яков Дмитриевич Захаров (1765-1836 гг.) совершил в Петербурге первый в истории науки воздушный полет для изучения верхних слоев атмосферы.)
19 (У автора "Schweflige Saure", т. е. сернистая кислота. Это явное недоразумение. В 1819 г. Гей-Люссак и Вельтер, пропуская на холоду сернистый газ во взвесь оксида марганца(IV) в воде, получили дитионат марганца(II) по реакции: MnO2 + 2SO2 = MnS2O6. Действуя на него гидроксидом бария, они приготовили дитионат бария BaS2O6. Осадив из его раствора барий в виде сульфата, они получили водную дитионовую кислоту: BaS2O6 + H2SO4 = BaSO4 + H2S2O6. Она устойчива только в водном растворе, при нагревании разлагается по реакции: H2S2O6 = H2SO4 + SO2. См.: Менделеев Д. И. Основы химии.- 2-е изд.- СПб, 1906, с. 712.)
20 (Совместные работы Гей-Люссака и Тенара опубликованы в их книге "Физико-химические исследования" (Париж, 1811, на французском языке). Из них следует упомянуть получение натрия и калия прокаливанием их гидроксидов с железными стружками и выделение бора восстановлением его триоксида В2О3 калием при нагревании (при этом опыте произошел взрыв, и Гей-Люссак временно лишился зрения). Разработанная ими методика элементного анализа была основана на окислении органических веществ хлоратом калия в углекислый газ и воду. Гей-Люссак позже заменил хлорат калия оксидом меди(II), окисление которым в отличие от хлората калия протекает спокойно.)
21 (Гей-Люссак сконструировал ареометр для определения содержания спирта в спиртоводпых растворах по их плотности и в 1824 г. написал инструкцию для его применения.)
22 (Объемный способ определения серебра по Гей-Люссаку состоит в приливании к раствору, содержащему ионы серебра, титрованного раствора хлорида натрия до прекращения выпадения хлорида серебра. Способ очень прост, быстр и точен; применяется и в наше время для анализа ювелирных и других сплавов серебра. Гей-Люссак разработал и методику титриметрического определения кислот и щелочей (1828 г.), а также активного хлора (1824 г.).)
23 (Камерный способ производства серной кислоты основан на окислении сернистого ангидрида оксидами азота (NO2 и N2O3) в присутствии воды. Отходящие газы, содержащие оксиды азота, выпускались наружу, что приводило к отравлению людей и животных, а также к гибели растений вокруг сернокислотных заводов. Для улавливания оксидов азота из отходящих газов Ге.й-Люссак разработал в 1827 г. башню из свинцовых листов, наполненную кусками пористого материала (кокса или шамотовых кирпичей). Отходящие газы поступают в низ башни, а навстречу им сверху непрерывно льется серная кислота крепостью не менее 75%. Такая кислота растворяет оксиды азота, этот раствор ("нитроза"; используется для окисления сернистого ангидрида.)
24 (О Гей-Люссаке см.: Джуа, с. 177-183; Манолов. Т. I, с. 204-227; Мусабеков, Черняк, с. 91-96; Соловьев, с. 144-149.)
25 (Эта работа Канниццаро под заглавием "Краткий очерк курса химической философии" была опубликована в 1858 г. в мало распространенном итальянском журнале. На Международном съезде химиков, состоявшемся в сентябре 1860 г. в Карлсруэ, по докладу Канниццаро были приняты основные положения атомно-молекулярной теории, основы которой заложил Авогадро. В съезде приняли участие виднейшие химики, в том числе русские ученые Ф. Ф. Бейльштейн, А. П. Бородин, Н. Н. Зинин, Д. И. Менделеев, Л. Н. Шишков. Принятые на съезде определения атома, молекулы и эквивалента положили конец существовавшему смешению этих понятий. См.: Фаерштейн М. Г. История учения о молекуле в химии (до 1860 г.).- М.: Изд. АН СССР, 1961; Быков Г. В., Крицман В. А. Станислао Канниццаро.- М.: Наука, 1972.)
26 (Об Авогадро см.: Быков Г. В. Амедео Авогадро. Очерк жизни и деятельности.- М.: Наука, 1970; Крицман В. А. Роберт Бойль, Джон Дальтон, Амедео Авогадро. Пособие для учащихся. М.: Просвещение, 1976; Джуа, с. 180-190, 210-218; Мусабеков, Черняк, с. 86-90; Соловьев, Т. 1, с. 149-153, 181-187.)
27 (Полное заглавие этой книги: "Беседы о химии, в которых общедоступно объясняются и иллюстрируются опытами основы этой науки" (т. 1-2, Лондон, 1806, на англ. яз.). Ее автор Мари Марсе (1769-1858) - жена швейцарского врача и химика Александра Марсе (1770-1822), эмигрировавшего в 1794 г. из Женевы в Англию. До конца XIX в. книга выдержала 26 изданий и неоднократно переводилась. Иногда ее автором ошибочно считают Александра Марсе.)
28 (Фарадей был также избран членом многих других академий и научных обществ, в том числе иностранным почетным членом Петербургской Академии наук [10 января 1831 г. (28 декабря 1830 г.)].)
29 (Есть русский перевод: Фарадей М. История свечи: Пер. с англ. М.: Детгиз, 1956 (Школьная библиотека).)
30 (Этим обоим углеводородам тогда приписывали формулу СН2 (в современных нам обозначениях). Напомним, что формула этилена Н2С = СН2, а изобутилена (СН3)2 = С = СН2. Но в то время не существовало ни понятия молекулярной массы, ни формул строения.)
31 (По реакции С2Н4 + 5Сl2 = С2Сl6 + 4НСl. Полученный продукт Фарадей не исследовал (Быков Г. В. История органической химии.- М.: Наука, 1978, с. 24).)
32 (Эти работы Фарадей начал в 1819 г. по предложению владельца фабрики ножевых изделий Дж. Стодарта и совместно с ним. Было изучено влияние небольших добавок никеля, хрома, серебра, золота, платины и других металлов на свойства стали (твердость, прочность, режущую способность, стойкость к ржавлению). Наиболее обнадеживающие результаты дали добавки хрома и никеля. Однако после смерти Стодарта в 1823 г. эти работы были прекращены, и Фарадей к ним больше не возвращался. Изучение и производство легированных сталей получило широкое развитие только в конце XIX - начале XX вв.)
33 (В 1825-1830 гг. Фарадей с сотрудниками занимался разработкой оптимального состава оптического стекла. Предложенное ими тяжелое свинцовое стекло (богатое PbO) содержало небольшую примесь буры. Это не дает основания называть такое стекло боросиликатным, так как боросиликатные стекла (йенское, пайрекс и др.), появившиеся в конце XIX - начале XX вв., свинца не содержат.)
34 (См.: Фарадей М. Силы материи и их взаимоотношения: Пер. с англ.- М.: 1940; его же, Экспериментальные исследования по электричеству: Т. I-III (Серия "Классики науки").- М.: Изд. АН СССР, 1947-1959; Радовский М. И. Михаил Фарадей.- М.- Л.: Госэнергоиздат, 1946; Шаховская Н. Т. Майкл Фарадей. 2-е изд.- М.- Л.: Детгиз, 1947; Манолов. Т. I; с. 246-263; Мусабеков, Черняк, с. 116-129.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'