
Глава III. Систематизация элементов
Йенс Якоб Берцелиус
Великие изменения в общественной жизни, происшедшие в конце XVIII в. в Европе и Америке, вызвали резкий подъем производительных сил, рост новых философских и естественнонаучных знаний. При этом было показано, что предполагавшееся ранее различие между органической и неорганической материей не так уж велико, что подкрепило тезис о материальном единстве мира. Большое значение для возникновения и развития таких материалистических представлений имели труды выдающихся химиков, биологов и физиков разных стран. Одним из важнейших научных центров того времени был Стокгольм, где Йене Якоб Берцелиус в своей лаборатории воспитывал будущих химиков из различных стран Европы.
Швеция, занимавшая долгое время ведущее положение в Северной Европе, несмотря на свое значительное экономическое развитие, к концу XVIII в. уже утратила прежнюю роль в международной политике. На этом фоне еще заметнее стал высокий уровень науки в Швеции. Такие великие ученые, как К. Линней и К. В. Шееле, прославили Академию наук Швеции, членами которой они являлись. В XIX в. шведская экономика получили мощный импульс для своего развития благодаря значительному росту потребности других стран в металле. В связи с этим древесина и железная руда стали важнейшими товарами шведского экспорта. Развитию и обновлению сельского хозяйства, путей сообщений и финансового дела страны в значительной мере способствовали средства, полученные от зарубежных государств, которые покупали по высоким ценам экспортируемое Швецией сырье.

Йенс Якоб Берцелиус (1779-1848)
Йенс Якоб Берцелиус родился 20 августа 1779 г. в селении Вёфесунда, расположенном в Эстерйетланде - самой южной провинции страны. Его отец был директором школы в Линчепинге - административном центре этой провинции. Берцелиус рано потерял родителей и был вынужден уже во время обучения в гимназии зарабатывать на жизнь, давая частные уроки. Эти и некоторые другие побочные занятия позволили любознательному юноше накопить деньги, достаточные для получения медицинского образования в Упсальском университете в 1797-1801 гг. По окончании курса Берцелиус был принят внештатным ассистентом в Хирургический институт Стокгольма. В это же время он познакомился с богатым владельцем железных рудников В. Хизингером, который интересовался естественнонаучными проблемами и оказывал поддержку молодым исследователям. Вместе с Хизингером Берцелиус создал свои первые приборы, в том числе и вольтов столб. В 1806 г. Берцелиус стал штатным преподавателем химии в высшей школе, а через год был избран профессором химии и фармации в незадолго до этого созданном Королевском медико-хирургическом институте Стокгольма. В 1808 г. Берцелиус стал членом Шведской Академии наук, в 1818 г.-ее президентом и непременным секретарем1.
В 1806 г. Берцелиус опубликовал первый том книги "Животная химия" - предшественницы классического учебника химии, увидевшего свет в 1808 г.
Со времени публикации своих первых работ Берцелиус поддерживал тесные личные связи с химиками во многих странах, что помогало ему создать четкое представление о мировом уровне разработки научных проблем. В Англии он встречался с Г. Дэви, в Париже учился у П. Дюлонга способам определения атомных масс. Во время пребывания в Берлине Берцелиус рекомендовал Э. Мичерлиха в качестве преемника знаменитого немецкого химика М. Клапрота на кафедре в университете. После завершения стажировки в лаборатории Берцелиуса в Стокгольме в 1822 г. Мичерлих занял должность профессора химии в Берлине (см. стр. 125).
Во время пребывания в 1821 г. на курортах в Карлсбаде и Мариенбаде Берцелиус вместе с Гёте совершал геологические экскурсии на гору Каммербюль неподалеку от Эгера. Во время этих походов Берцелиус познакомил Гёте с основами анализа минералов при помощи паяльной трубки.
Для работы в Стокгольмской лаборатории Берцелиус отобрал нескольких талантливых химиков. Наиболее известными из них стали X. Г. Гмелин, Генрих и Густав Розе, Э. Мичерлих и Ф. Вёлер2. Все ученики Берцелиуса, ставшие впоследствии выдающимися химиками, вспоминали с благодарностью плодотворный обмен мнениями в его лаборатории и оказанную учителем помощь в обсуждении экспериментов. Так Берцелиус стимулировал работу своих учеников, не отнимая у них инициативы мелочной опекой.
Скончался Берцелиус 7 августа 1848 г. в Стокгольме. Его научная деятельность оказала решающее влияние на развитие химии в первой половине XIX в. Берцелиус был учителем целого поколения химиков. Многие научные работы Берцелиуса были основаны на материалистической диалектике. Наиболее ярким примером являются его исследования состава веществ на основе атомной теории Дальтона и новых для того времени представлений о роли электричества в химических превращениях. В то же время мировоззрение Берцелиуса не было вполне свободно от идеалистической натурфилософии XVIII в. Об этом говорит его решительная защита витализма3.
Наиболее важным вкладом Берцелиуса в развитие химии являются разработка атомистической теории Дальтона и подтверждение законов постоянных и кратных отношений фундаментально проведенными анализами: анализу были подвергнуты 2000 соединений, образованных 43 элементами4.
Результатом этих работ было усовершенствование старых и создание новых методов анализа, изобретение новых приборов и развитие техники лабораторных работ.
Среди многочисленной аппаратуры, созданной Берцелиусом, наиболее известны: промывалка, химические стаканы, спиртовая лампа с двойной тягой воздуха, фильтровальная бумага, промытая соляной и плавиковой кислотами.
Одним из наиболее значительных научных достижений Берцелиуса было создание им таблицы атомных масс. Существенную помощь при этом Берцелиусу оказал закон объемных отношений газов, установленный Ж. Л. Гей-Люссаком. Значение этого закона Берцелиус понял сразу же после ознакомления с работой французского ученого, относящейся к 1808 г.
Первую таблицу атомных масс Берцелиус опубликовал в 1814 г. В отличие от Дальтона Берцелиус принял за основу для расчетов атомную массу кислорода, а не водорода: уже в то время было известно больше соединений кислорода, чем водорода. Атомную массу кислорода шведский ученый условно принял равной 100. Ж. С. Стае впоследствии пересчитал атомные массы элементов, приняв атомную массу кислорода равной 16. С 1818 г. по 1826 г. Берцелиус несколько раз исправлял значения атомных масс, используя открытые в 1819 г. законы изоморфизма Мичерлиха и атомных теплоемкостей Дюлонга и А. Пти.
В результате этих исследований Берцелиус значительно уточнил величины атомных масс, определенные Дальтоном. Тем самым были созданы предпосылки систематизации элементов на основе их атомных масс. Эти тщательно выполненные исследования позволили Берцелиусу сделать атомистическую теорию основой химии.
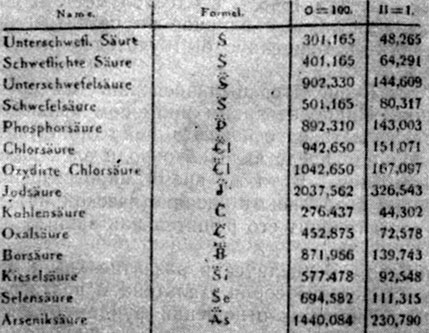
Формулы химических соединений в записи, предложенной Берцелиусом (кислород обозначается точками)
Экспериментальные работы, проведенные во второй половине XVIII - начале XIX вв. Б. Франклином, Л. Гальвани, А. Вольтой и другими исследователями, привлекли внимание естествоиспытателей и философов к электрическим явлениям. Результаты этих открытий и выводы из них побудили Берцелиуса к разработке электрохимической теории. Приняв за основу электрохимические представления Дэви, Берцелиус считал причиной соединения элементов в определенных отношениях электрическую полярность атомов. Учение об электричестве позволило дать простое объяснение природе, например, такого распространенного в химии превращения, как образование солей. Оказалось, что суть этого процесса заключается во взаимной нейтрализации положительных и отрицательных зарядов мельчайших частичек веществ. На основании разработанной им электрохимической системы Берцелиус сделал принципиально важный вывод: все химические соединения состоят из отрицательных и положительных частиц. Созданная Берцелиусом на этом основании дуалистическая система явилась попыткой рассмотреть химическое сродство как стремление к уравниванию различных электрических полярностей атомов или их групп. Тем самым развивались представления Дэви, что существует определенная причинная обусловленность явлений химического сродства и электрических процессов. Однако ограниченность дуалистических представлений мешала химикам понять механизм превращений, протекающих иначе, чем образование солей. Так, электрохимическая теория Берцелиуса затруднила признание гипотезы Авогадро, имеющей более общую область применения в химии. При помощи дуалистических представлений нельзя было также объяснить многоатомность молекул газообразных простых веществ.
Существенное значение для превращения химии в точную науку имело усовершенствование Берцелиусом химической номенклатуры и создание им символики, близкой к современным обозначениям элементов и их соединений. Она заменила химические знаки Дальтона, в которых чувствовалось влияние алхимической символики. Для обозначения химических элементов Берцелиус предложил применять начальные буквы их латинских названий5.
Исходя из своей электрохимической теории Берцелиус предложил принцип наименования соединений, состоящих из положительных и отрицательных частей. Например, сульфат меди он рассматривал как сернокислый оксид меди (CuO+*SО-3). В своей химической символике Берцелиус хотел отразить и количественное соотношение элементов в соединениях. Уже в 1815 г. он объяснил, что приводимые им формулы должны также "облегчать выражение отношений в химических соединениях... чтобы можно было бы однозначно отразить относительные массы соединяющихся частиц в каждом сложном теле. Если мы будем знать массу элементарной частицы, эти формулы... должны нам позволить выразить результаты количественного анализа таким же простым и легким для изображения способом, как это позволяют делать алгебраические формулы в механике" [36, с. 240 и сл.].
Созданный Берцелиусом "химический язык" позволил простым и наглядным образом сопоставлять особенности химических явлений с составом взаимодействующих молекул. Тем самым этот "язык" в значительной мере способствовал взаимопониманию химиков разных стран и укреплению их научных контактов.
В результате своих аналитических работ Берцелиус открыл несколько новых элементов. Так, в 1803 г. вместе с В. Хизингером Берцелиус открыл элемент церий, который тогда же и независимо от шведских ученых обнаружил Клапрот. В 1817 г. Берцелиус выделил из шлама свинцовых камер сернокислотного производства в маленьком шведском городке Грипсхольме неизвестный до этого элемент - селен6. Тогда же Берцелиус установил, что по свойствам селен близок к теллуру. В 1828 г. Берцелиус открыл в минерале, найденном в Норвегии, элемент торий. Вместе со своим учеником Н. Г. Сефстрёмом Берцелиус обнаружил в 1830 г. новый элемент ванадий. Впоследствии Берцелиусу удалось получить элементы, оксиды которых уже были известны: кремний, цирконий, титан, тантал6.
Для развития органического анализа большое значение имело усовершенствование Берцелиусом методов количественного определения углерода и водорода7.
Будучи одним из лучших знатоков химии своего времени, Берцелиус объяснил с единой точки зрения многие факты и понятия, ранее казавшиеся не связанными друг с другом. Так, даже горные породы и минералы в подаренной ему коллекции Берцелиус расположил не в соответствии с общепринятой тогда кристаллографической систематизацией Р. Ж. Аюи, а по их химическому составу8.

Гэмфри Дэви (1778-1829); выдающийся английский естествоиспытатель; основатель электрохимии; получил щелочные металлы из оксидов путем электролиза
Сделав анализы винной и виноградной кислот, Берцелиус установил, что обе они имеют "одинаковый процентный и атомный состав" [37, с. 321]. Показав тесную связь этих наблюдений с результатами своих более ранних исследований состава оловянной кислоты, а также работ Либиха и Вёлера, изучивших фульминаты и цианаты, работ Фарадея и Вёлера, анализировавших цианат аммония и мочевину (диамид угольной кислоты), Берцелиус предложил назвать эти явления изомерией9. Он же ввел в науку термин "аллотропия", сравнивая различные видоизменения простых веществ10.
Сопоставив результаты исследований этерификации, проведенных, по его совету, Мичерлихом, с наблюдениями Дёберейнера, Дэви и других ученых над реакциями окисления в присутствии платины, Берцелиус ввел в науку в 1836 г. понятие катализа. "Сущность каталитической силы состоит в том,- писал Берцелиус,- что тело лишь одним своим присутствием, а не благодаря химическому сродству, не проявляющемуся при этой температуре, может возбуждать дремлющие химические сродства взаимодействующих веществ" [38, с. 243-244]. Так в результате своих работ Берцелиус объединил представления о природе гомогенных и гетерогенных каталитических реакций. Однако, встретив сопротивление таких выдающихся ученых, как Либих и X. Шёнбейн, Берцелиус не смог отстоять своих представлений о катализе. И хотя сам Шёнбейн впоследствии провел замечательные исследования каталитических явлений, понятие катализа прочно вошло в химию лишь благодаря работам В. Оствальда спустя полвека после смерти Берцелиуса.
Берцелиус опубликовал около двухсот пятидесяти работ, среди которых - большой многотомный учебник химии, выдержавший несколько изданий11 (в том числе переводы на немецкий и французский языки).
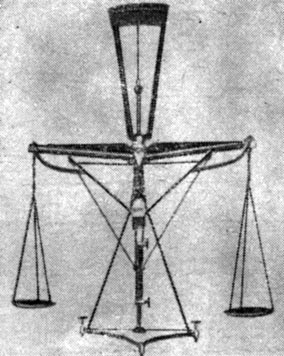
Аналитические весы Й. Берцелиуса (точность взвешивания до 5 мг)
Издаваемые Берцелиусом ежегодные обзоры успехов химии были, по существу, первым наиболее полным информационным изданием, рассказывающим об основных достижениях в этой бурно развивающейся области науки. Они оказали значительное влияние на выработку химических воззрений, основанных на его теоретических представлениях12.
Создание новых основных понятий, таких, как изомерия и полимерия, значительное совершенствование химической символики и номенклатуры, обширная литературная деятельность Берцелиуса несмотря на то что он упорно придерживался дуалистических электрохимических представлений, оказала существенное влияние на развитие современной химии13.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'