
Иоханн Наколаус Брёнстед. Михаил Ильич Усанович
В истории химии понятия кислота и основание прошли долгий путь развития. В последние пятьдесят лет, после возникновения электронной теории валентности, были созданы новые благоприятные условия их совершенствования. В работах Брёнстеда и Усановича эти представления были высказаны наиболее отчетливо61. Первое общеприемлемое определение кислот и оснований стало возможным лишь на основе теории электролитической диссоциации Аррениуса. Математическую трактовку свойств кислот и оснований дал Сёренсен в 1909 г., введя величину рН. Границы применимости этих взглядов были установлены при исследовании растворов веществ в водоподобных растворителях, как, например, жидкий аммиак. В установлении более широкого понятия принимали участие такие ученые, как англичанин Лаури и датчане Брёнстед и Бьеррум.

Брёнстед Иоханн Николаус (1879-1947)
Иоханн Николаус Брёнстед родился 22 февраля 1879 г. в Барде (Дания). В 1897 г. стал студентом в Копенгагене. В 1899 г. Брёнстед сдал экзамен на звание инженера, спустя три года стал магистром, а в 1908 г. - доктором наук. Брёнстед был профессором химии копенгагенского университета и директором политехнического отделения физико-химической лаборатории. В 1930 г. он стал директором Физико-химического института Высшей технической школы в Копенгагене.
В своей исследовательской работе, например, при изучении сродства, Брёнстед всегда пользовался количественными расчетами. В его многочисленных публикациях имеются сообщения об осмотических коэффициентах, коэффициентах активности, теплоемкости и электродвижущих силах. Обширные исследования растворов нашли отражение во многих статьях, публиковавшихся им с 1914 г. в научных журналах.
В 1912 г. Брёнстед принимал участие в написании "Учебника физической химии", в 1916 г. были опубликованы его "Основы неорганической химии".
В двадцатых годах Брёнстед работал вместе с Хевеши над раз-делением изотопов при помощи фракционной перегонки и над определением атомных масс ртути и хлора. В 1921 г. был избран председателем Рамзаевского комитета.
На основании своих обширных исследований свойств растворов солей Брёнстед в 1923 г. пришел к новому определению понятия кислоты. Исходя из результатов измерения физико-химических свойств растворов и опираясь на теорию Аррениуса, а также на закон действия масс, он достиг углубленного общего понимания характера кислот, отщепляющих протон, т. е. кислот в классическом смысле.
В 1926 г. Брёнстед был приглашен на несколько лет в США для чтения лекций в Йельском и Колумбийском университетах, а также в других американских высших учебных заведениях. В 1928 г. Брёнстед был награжден медалью Эрстеда. Через год его избрали членом Американской Академии искусств и наук. В то же время он продолжал разрабатывать теорию кислот и теорию каталитических процессов. Особое внимание Брёнстед уделил изучению реакций, катализируемых кислотами и основаниями. Наряду с этим Брёнстед продолжал начатые ранее физико-химические исследования термодинамических свойств растворов. В дальнейшем он расширил область своих работ проведением интенсивных исследований по коллоидной химии, изучая влияние растворителя на некоторые реакции и, наконец, занимаясь физико-химическими исследованиями свойств высокомолекулярных соединений. Брёнстед скончался в Копенгагене 17 декабря 1947 г. в возрасте 68 лет.
Уже при жизни Брёнстед заслужил уважение и восхищение ученых за созданную им теорию кислот и оснований.
Брёнстед определял кислоты и основания в зависимости от роли, которую играет ион водорода в системе кислота - основание:
кислота 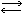 основание + протон
основание + протон
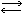 основание + протон
основание + протонВ дальнейшем исследования Вальдена, Яндера, Сиджвика, а также Льюиса показали необходимость более общего определения понятий кислота и основание. В том же году, что и Брёнстед и Лаури, Г. Н. Льюис сформулировал свои мысли о расширении области применения кислот и оснований. В обосновании своей теории Льюис исходил из электронной структуры кислот и оснований и из функции электронной пары при образовании координационной ковалентной связи. По Льюису поведение кислот и оснований характеризуется четырьмя критериями, поддающимися экспериментальной проверке:
- Превращение кислот и оснований в конечные нейтральные продукты происходит очень быстро.
- Кислота (основание) вытесняет более слабую кислоту (основание) из их соединений.
- Кислоты и основания могут взаимно титроваться с применением цветных индикаторов.
- Кислоты и основания могут оказывать очень сильное влияние на ускорение химических процессов за счет каталитического действия.
С учетом всего этого Льюис, сводя свойства веществ к их электронной структуре, пришел к следующим определениям понятий кислоты и основания:
- кислоты - частицы, присоединяющие электронную пару при образовании ковалентной связи; основания - частицы, отдающие пару электронов при образовании ковалентной связи.
Дальнейшим развитием теории Брёнстеда можно считать определение понятия "кислота", предложенное Усановичем. Это определение гораздо шире того, которое дал Брёнстед, и освобождает химическую мысль от ограничений, неизбежно вносимых теорией водородных кислот.
Усанович считает теорию Брёнстеда вершиной водородной теории. В работе, опубликованной в 1964 г., Усанович указал на принципиальные границы дальнейшей эволюции представлений подобного рода62. Тем самым он подвел итоги определенному этапу развития химической науки. Только под углом зрения новой научной эпохи можно было с исчерпывающей ясностью занять окончательную позицию по отношению к устаревшим представлениям о классах веществ и классических понятиях "кислота" и "основание".
Михаил Ильич Усанович родился 16 июня 1894 г. в семье врача в городе Житомире на Украине. В 1912 г. окончил с золотой медалью гимназию. До 1917 г. учился на физико-математическом факультете Киевского университета.

Михаил Ильич Усанович (род. в 1894 г.)
Преподавательскую деятельность Усанович начал в 1918 г. на Вечерних высших женских курсах в Киеве. В то же время работал под руководством Вернадского в биогеохимической лаборатории Украинской Академии наук. С 1924 г. Усанович работал в Киевском политехническом институте на кафедре Плотникова и одновременно руководил химико-фармацевтическим заводом.
В 1929 г. он переехал в Томск, где работал вначале на кафедре аналитической химии, а позже на кафедре неорганической химии университета. В 1930 г. Усанович стал профессором. Спустя пять лет его избрали заведующим кафедрой физической химии Среднеазиатского университета в Ташкенте и директором Химического института при этом университете. В 1944 г. Усанович стал заведующим кафедрой физической химии Казахского университета в г. Алма-Ата. В 1946 г. был избран членом-корреспондентом, а в 1962 г. действительным членом Академии наук Казахской ССР. Награжден орденами и медалями СССР, а также отмечен академическими отличиями (в числе которых почетный знак Высшей педагогической школы в Потсдаме).
Многочисленные экспериментальные исследования электропроводности и вязкости растворов галогенидов металлов, а также ряда водородных кислот и органических кислородсодержащих и азотсодержащих веществах привели Усановича к очень важному заключению: необходимым условием возникновения электропроводности в смеси непроводящих веществ является образование стехиометрического соединения. Приняв, что электролитом в двойной системе является образующееся соединение, что этот процесс подчиняется закону действия масс и что проводимость раствора пропорциональна концентрации электролита, Усанович вывел зависимость электропроводности от концентрации.
Уже в этой работе сделана попытка создать количественную теорию, распространяющуюся на все электролиты и на любые концентрации. Кривая зависимости температурного коэффициента электропроводности от концентрации этих растворов имеет экстремальное значение, приходящееся на состав образующегося соединения. Придя к выводу, что электропроводность обусловлена соединениями, образующимися в растворах, Усанович подверг ревизии общепринятое толкование максимума удельной электропроводности и показал, что этот максимум не вытекает из классической теории электролитической диссоциации и противоречит закону Оствальда. Из закона Оствальда следует, что удельная электропроводность с ростом концентрации электролита замедленно возрастает, но не проходит через максимум.
Наличие или отсутствие максимума удельной электропроводности в системе, электропроводность которой не возникает вследствие реакции, а присуща одному из компонентов, зависит от вязкости раствора и определяется отношением вязкостей компонентов, а не величиной диэлектрической проницаемости растворителя. При исправлении удельной электропроводности умножением на вязкость максимум на кривой может оставаться лишь в тех случаях, когда компоненты системы образуют соединения, проводящие электрический ток. Наличие или отсутствие максимума на диаграммах исправленной электропроводности может служить критерием для качественной оценки образования соединений. Эта величина - исправленная электропроводность - показывает, как далеко прошла реакция между кислотой и основанием. Все эти положения свидетельствуют против существования особой ионизирующей способности растворителей и окончательно опровергают теорию электролитической диссоциации Аррениуса.
С рассмотренными вопросами тесно связано явление аномальной электропроводности, открытое в 1899 г. Математический анализ аномальных кривых привел Усановича к заключению, что нормальных кривых электропроводности не существует; а "аномальные" кривые представляют норму, а вовсе не исключение.
Из всего этого Усанович сделал вывод, что предпосылкой появления электропроводности является реакция между кислотой и основанием, приводящая к образованию электролита, т. е. соли. В качестве кислот в этих случаях выступают и такие вещества, как трихлорид мышьяка, трихлорид сурьмы и т. д. Следовательно, необходимо новое определение понятий кислота и основание.
В 1938 г. Усанович опубликовал изложение своих теоретических воззрений на кислоты и основания. Основное положение этой теории состоит в отказе от водорода как универсального носителя кислотных свойств соединений. По Усановичу, кислотами являются все вещества, которые могут реагировать с основаниями, образуя соли. Очень многие из этих веществ не содержат в своем составе водорода. В частности, к кислотам должны быть причисленны все катионы. Амфотерность трактуется следующим образом: вообще все полярные вещества амфотерны. Способность веществ реагировать как кислота или как основание в зависимости от природы соответствующего сореагента доказывает относительный характер химических свойств веществ. Реакции между веществами, обладающими противоположными (кислотными или основными) свойствами, приводят к ослаблению, но не к полному исчезновению этих свойств. На этом основании Усанович сделал неизбежный вывод, что как кислотность, так и основность - свойства, присущие в той или иной степени каждому веществу, а вовсе не связанные с принадлежностью к определенному классу соединений. Все это показывает, что теория Усановича отличается наиболее глубоким диалектическим рассмотрением понятия кислота. Изложенные соображения убеждают в том, что при рассмотрении вопроса о кислотах и основаниях речь идет о химических функциях, а не о классах веществ. Понятия о кислоте и основании находятся в такой же взаимозависимости, как понятия "окислитель" и "восстановитель". Реакции комплексообразования также рассматриваются как кислотно-основное взаимодействие.
В последние три десятилетия Усанович углубил положения своей общей теории кислот и оснований, анализируя результаты многих экспериментальных исследований, проведенных в эти годы.
Произведенные им и его сотрудниками исследования реакций галогенидов олова, титана, мышьяка, сурьмы и других металлов представляют особый интерес для химии комплексных соединений. В работах по изучению растворов основным методом исследования является физико-химический анализ. Усанович обнаружил интересные отношения между термодинамическими свойствами. Он изучал электропроводность, вязкость, их температурные коэффициенты, показатель преломления и другие физические свойства растворов (давление пара, температуры плавления и кипения); кроме того он анализировал закономерности, связывающие свойства растворов с их составом.
За время его многолетней творческой деятельности из его школы вышло более шестидесяти кандидатов наук. Около двадцати из них стали докторами наук и профессорами, а двое избраны действительными членами Академий наук союзных республик СССР.
Имена Брёнстеда и Усановича неразрывно связаны с развитием теории кислот и оснований. Воззрения этих ученых представляют наиболее значительное достижение в этой области. В теоретических положениях Брёнстеда и Усановича были развиты идеи многих химиков, изучавших проблему кислот и оснований.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'