
3. Номенклатура
Создать рациональную номенклатуру координационных соединений до появления координационной теории Вернера было невозможно. Как только стало ясно, что координационные соединения могут быть либо солями, либо соединениями неионного характера, появилась возможность разработать систематическую схему их наименования. Соли называли, как обычно, двумя словами, а неионные соединения - одним. Например, [Co(NH3)6]Cl3 называли гексаамминкобальти хлорид, а [Pt(NH3)2Cl2] - дихлородиамминплатина. По этой номенклатуре суффиксы а, о, и, е применяли для обозначения 1+-, 2+-, 3+- и 4+ - степеней окисления металла. Этот способ наименований в настоящее время заменен системой Стока с использованием для обозначения степени окисления римских цифр в круглых скобках. Так, [Co(NH3)6]Cl3 называют гексаамминкобальт(III) хлорид, а [Pt(NH3)2Cl2] - дихлородиамминплатина(III). Ниже приведена система номенклатуры, рекомендованная Комитетом по номенклатуре неорганических соединений, организованным Международным союзом по теоретической и прикладной химии; в тексте использована только эта номенклатура.
Порядок перечисления ионов
Сначала называют катион, а затем анион. Это обычный способ названия солей:
- NaCl - натрия хлорид*,
- [Cr(NH3)6](NO3)3 - гексаамминхром(III) нитрат,
- K2[PtCl6] - калия гексахлороплатинат(IV).
* (Здесь сохранена номенклатура соединений, использованная в оригинале; в русской терминологии принята обратная последовательность слов (NaCl - хлорид натрия).- Прим. ред.)
Неионные соединения
Неионные или молекулярные соединения называют одним словом:
- [Co(NH3)3(NO2)3] - тринитротриамминкобальт(III),
- [Cu(CH3COCH2COCH3)2] - бис-(ацетилацетонато)медь(II), где CH3COCH2COCH3 - ацетил ацетон.
Название лигандов
Нейтральные лиганды называют так же, как и соответствующую молекулу; к лигандам-анионам добавляют на конце суффикс о, а к лигандам-катионам (редкий случай) - суффикс иум:
- NH2CH2CH2NH2 - этилендиамин,
- (C6H5)3P - трифенилфосфин,
- Cl- - хлоро,
- CH3COO- - ацетато,
- NH2NH3+ - гидразиниум.
Имеется два исключения из этого правила - вода и аммиак:
- H2O - акво,
- NH3 - аммин (следует указать, что это название пишется с двумя "м"; это относится только к аммиаку, другие амины пишутся с одним "м"),
Порядок лигандов
Лиганды в комплексе называют в следующем порядке: 1) отрицательные, 2) нейтральные и 3) положительные, не разделяя их дефисами. Внутри каждой из этих категорий лиганды перечисляются в порядке увеличения их сложности:
- [Pt(NH3)4(NO2)Cl]SO4 - хлоронитротетраамминплатина(IV) сульфат,
- NH4[Cr(NH3)2(NCS)4] - аммония тетратиоцианатодиамминхромат(III).
Числовые приставки
Приставки ди-, три-, тетра- и так далее применяют перед названием простых лигандов: бромо, нитро, оксалато. Приставки бис-, трис-, тетракис- и так далее применяют перед сложными наименованиями лигандов (главным образом в названиях тех комплексов, в которых лиганды уже содержат приставки моно-, ди-, три- и т. д.), как, например, этилендиамин или триалкилфосфин:
- K3[Al(C2O4)3] - калия триоксалатоалюминат(III),
- [Co(en)2Cl2]2SO4 - дихлоро-бис-(этилендиамин)кобальт(III) сульфат, где en = NH2CH2CH2NH2 - этилендиамин.
Окончание названий
Названия анионных комплексов оканчиваются на "ат". В катионных или нейтральных комплексах металл называют без какого-либо специфического окончания:
- Ca2[Fe(CN)6] - кальция гексацианоферрат(II),
- [Fe(H2O)6]SO4 - гексааквожелезо(II) сульфат,
- [Ni(DMG)2] - бис-(диметилглиоксимато)никель(II), где
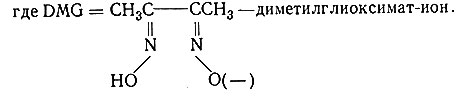 - диметилглиоксимат-ион.
- диметилглиоксимат-ион.
Степени окисления
Степень окисления центрального атома обозначают римскими цифрами в круглых скобках в конце названия комплекса без свободного пространства между ними, Для отрицательных степеней окисления знак минус стоит перед римской цифрой, а цифра 0 означает нулевую степень окисления:
- Na[Co(CO)4] - натрия тетракарбонилкобальтат(-1),
- K4[Ni(CN)4] - калия тетрацианоникелат(0).
Мостиковые группы
Лигандам, связывающим два центральных атома, предшествует в названии греческая буква μ, которая повторяется перед каждым различным видом мостиковой группы:

Место присоединения
Если необходимо указать место присоединения лиганда, после названия группы ставят курсивом обозначение присоединяемого элемента, которое отделяют дефисом:
- (NH4)3[Cr(NCS)6] - аммония гексатиоцианато-N-хромат(III),
- (NH4)2[Pt(SCN)6] - аммония гексатиоцианато-S-платинат(IV).
Для тиоцианат- и нитрат-ионов используют также следующие названия:
- -SCN- - тиоцианато,
- -NO2- - нитро,
- -NCS- - изотиоцианато,
- -ONO- - нитрито.
Пространственные изомеры
Пространственная и оптическая изомерия будут рассмотрены в разд. 3 и 4 гл. III. Названия изомерных веществ включены здесь для полноты описания. Пространственные изомеры вообще называют, используя слова цис- для обозначения смежных положений лигандов и транс- для обозначения противоположных. Иногда для обозначения положений каждого лиганда нужно использовать систему чисел. Для плоских квадратных комплексов группы 1-3 и 2-4 находятся в транс-положениях. Отметим, что в названии второго комплекса необходимы только две цифры, обозначающие транс-положение. Это обусловлено тем, что в плоских квадратных комплексах два других лиганда должны быть тоже в транс-положении относительно друг друга. Так как положения 2 и 4 эквивалентны, эти номера могут быть опущены. Для наглядного представления этих комплексов полезны простые модели.
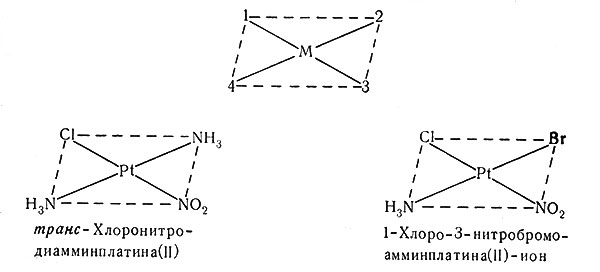
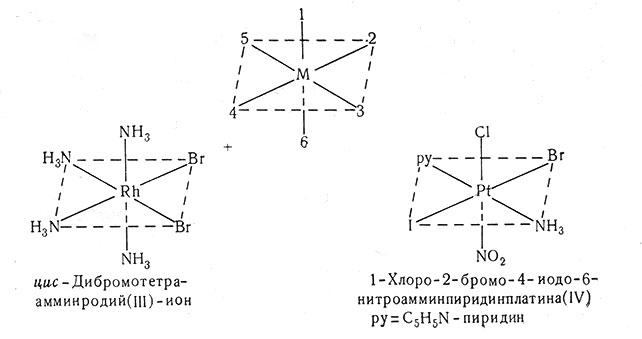
Для октаэдрических комплексов транс-положения имеют номера 1-6, 2-4 и 3-5. Рациональное название последнего соединения - транс-хлоронитро-транс-бромоиодоамминпиридинплатина (IV).
Оптические изомеры
Номенклатура оптически активных органических соединений следующая. Право (dexiro)- и лево (levo)- вращающие соединения соответственно обозначаются знаками (+) и (-) или буквами d и l:
(+), или d-K3[Ir(C2O4)3], калия(+), или d-триоксалатоиридат(III).
Сокращения
Названия сложных молекул в координационных соединениях обычно сокращают. К сожалению, в использовании сокращений названий всех лигандов еще не пришли к единому мнению. Некоторые обычные сокращения, а также сокращения, используемые в данной книге, приведены в табл. 6.
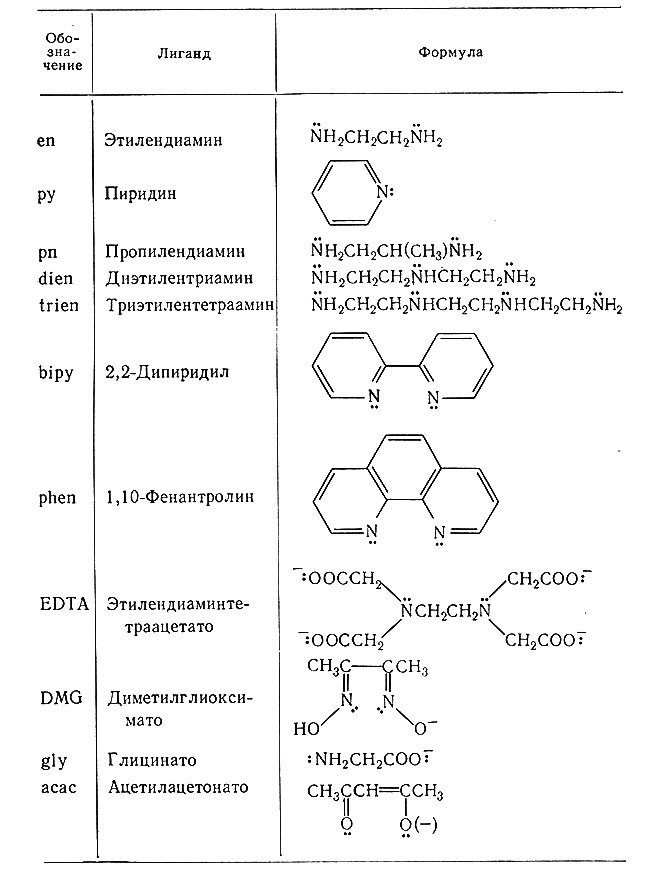
Таблица 6. Обозначения, применяемые для некоторых лигандов
Смешанная терминология
Здесь удобно привести определение, или скорее описание, некоторых пока еще не введенных терминов. Молекула этилендиамина (en) занимает два координационных места и поэтому ведет себя как две связанные между собой молекулы аммиака.
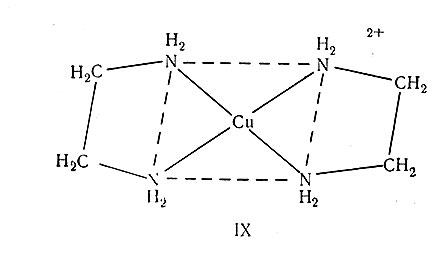
Другие молекулы способны присоединяться к центральному атому даже больше, чем двумя своими атомами; например, EDTA может присоединяться тремя и шестью атомами соответственно (табл. 6). Такие группы называются полидентатными или хелатообразующими лигандами. Точное применение прилагательного "хелатообразующий" лучше показать на конкретном примере. Соль [Cu(en)2]SЩ4 (IX) называется хелатным соединением, комплексный катион - хелатным ионом, а этилендиамин - хелатообразующим лигандом. Последний называют также бидентатной группой или лигандом. В случае большего числа мест присоединения используют следующие термины: три - тридентатный, четыре - тетрадентатный, пять - пентадентатный, шесть - гексадентатный лиганды.
Когда атом лиганда присоединен к двум ионам металла, то лиганд называют мостиковой группой (см. мостиковые группы). Получившийся комплекс часто называют "полиядерным комплексом", но лучше использовать термин мостиковый комплекс, так как приставка "поли" обычно означает соединение с высоким молекулярным весом, в то время как рассматриваемые вещества чаще всего лишь димеры или тримеры.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'