
2. Историческое развитие
Наука обычно развивается одним и тем же путем: вначале происходит накапливание опытных фактов посредством тщательно проводимых экспериментов, которое сопровождается попыткой объяснить и привести их в соответствие с подходящей теорией. Следует учесть, что в отличие от опытных фактов теории часто могут изменяться при получении более подробной информации. Содержание этой и следующих глав может служить хорошим примером того, как может изменяться теория, иногда даже до полного ее отрицания.
Открытие
Трудно установить, когда точно впервые были открыты комплексы металлов. Возможно, раньше всего была описана прусская голубая KCN*Fe(CN)2*Fe(CN)3, которая была получена Дисбахом, готовившим краски для художников в Берлине в начале XVIII в. Однако обычно считают, что первым был открыт в 1798 г. Тассэром гексаамминкобальт(III)хлорид. Это открытие является действительным началом развития химии координационных соединений, так как существование со своеобразными свойствами CoCl3*6NH3 вызвало к нему и к аналогичным системам большой интерес. Несмотря на то что открытие Тассэра было случайным, но понимание им того, что он нашел нечто новое и отличное от известного ранее, подтверждало его способности исследователя.
Экспериментальные наблюдения Тассэра не могли быть объяснены на основе химических представлений, существовавших в то время; необходимо было понять, как CoCl3 и NH3, сами по себе устойчивые соединения, по-видимому с насыщенной валентностью, могут реагировать и давать другое очень устойчивое химическое соединение. Это озадачило химиков и стимулировало их дальнейшие исследования в этой области. Однако ответ был найден столетием позже. За это время были приготовлены многие соединения такого же типа и изучены их свойства. Были предложены некоторые теории, которые затем отвергли, так как они не смогли объяснить последующие экспериментальные данные.
Получение и свойства
Получение комплексов металлов обычно предусматривает реакцию между молекулой соли и какой-либо другой молекулой или ионом (гл. IV). Многие ранние работы были проведены с аммиаком; получающиеся комплексы были названы амминами металлов. Было обнаружено, что другие амины и такие анионы, как CN-, NO-3, NCS- и Cl-, также образуют комплексы металлов. При помощи этих анионов было приготовлено много соединений, каждое из которых сначала было названо по имени химика, который его получил (табл. 1). Некоторые из этих названий сохранились до сих пор; но скоро оказалось, что такая номенклатура неудовлетворительна.
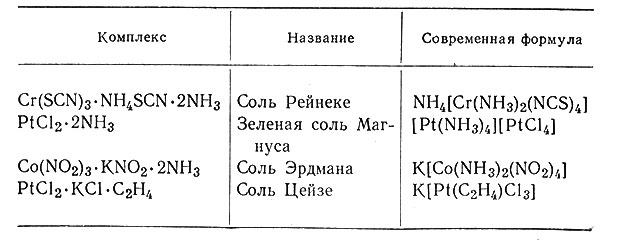
Таблица 1. Название соединений по имени их открывателей
Так как многие комплексные соединения окрашены, то возникла система их названий по окраске (табл. 2).
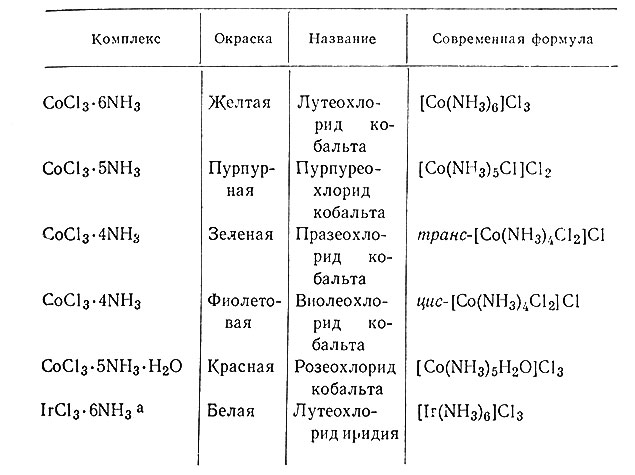
Таблица 2. Комплексные соединения, названные по их окраске
а (В названии этого соединения есть приставка лутео вследствие того, что комплекс содержит шесть молекул NH3, а не из-за его окраски (см. текст).)
В основе такой системы лежит тот факт, что окраска хлорамминных комплексов кобальта(III) и хрома(III), содержащих одинаковое число молекул аммиака, очень близка. В дальнейшем эта система была использована для обозначения числа молекул аммиака в комплексе без учета окраски. Например, IrCl3*6NH3 белого цвета, а не желтого, как означает приставка лутео. Очевидно, такая система не практична, и вскоре она была отброшена. Применяемая в настоящее время система номенклатуры описана в конце данной главы.
Хлорамминные комплексы кобальта(III) [и аналогичные комплексы хрома(III)] отличаются от своих хлоридов не только окраской, но и реакционной способностью. Например, добавление к раствору нитрата серебра свежеприготовленного раствора CoCl3*6NH3 приводит к немедленному осаждению всех ионов хлора. Тот же опыт с CoCl3*5NH3 показывает, что в этом случае осаждаются только 2/3 ионов хлора; 1/3 ионов осаждается медленно при продолжительном стоянии. Результаты таких исследований приведены в табл. 3. На основании этих наблюдений можно предположить, что в CoCl3*6NH3 и IrCl3*6NH3 все ионы хлора одинаковы, а в CoCl3*5NH3 и CoCl3*4NH3 имеется два разных типа ионов хлора. Один тип, возможно, аналогичен ионам хлора в хлористом натрии и легко осаждается в виде хлористого серебра, в то время как другой тип ионов хлора прочно удерживается в комплексе и не осаждается при действии нитрата серебра.
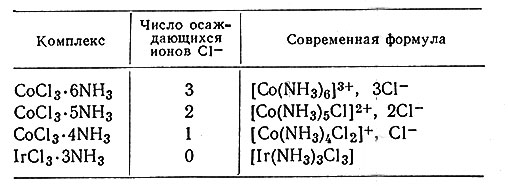
Таблица 3. Число ионов хлора в комплексе, осаждающихся из раствора в виде AgCl
Полезную информацию о числе ионов, образующихся в растворе из различных комплексов, дает и иной род опытов. Чем больше число ионов в растворе, тем больше его электропроводность. Поэтому сравнение электропроводности растворов, содержащих координационные соединения с одной и той же концентрацией, позволяет оценить число ионов в каждом комплексном соединении. Эти сведения были получены для нескольких серий комплексов; некоторые данные приведены в табл. 4. Результаты показывают, что с уменьшением числа молекул аммиака в комплексе число ионов также падает до нуля, а затем снова возрастает.
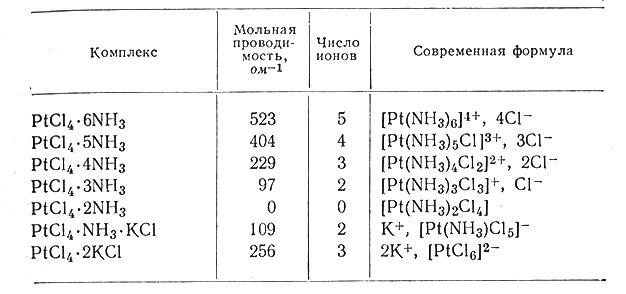
Таблица 4. Мольная проводимость комплексов платины (IV)
Кроме того, уже давно было замечено, что некоторые комплексы, имеющие один и тот же химический состав, существуют в двух разных формах. Примерами могут служить зеленая и фиолетовая разновидности CoCl3*4NH3. Обе формы не всегда отличаются только по цвету; часто у них различны и другие физические и химические свойства. Например, α- и β-формы PtCl2*2NH3; обе имеют одинаковый кремовый цвет, но отличаются растворимостью и химической активностью.
Все полученные экспериментальные данные необходимо было обобщить подходящей теорией, и поэтому было выдвинуто несколько гипотез и теорий. Здесь будет рассмотрена одна из них, которая была распространена достаточно широко, а потом оказалась ошибочной. Кроме того, будет обсуждена также координационная теория Вернера, которая устояла перед испытанием временем и дала удовлетворительное объяснение существования и поведения комплексов металлов.
Цепная теория Бломстранда - Иергенсена
Развитие структурной теории органических соединений предшествовало появлению такой же теории для комплексных соединений; таким образом, ученые начали рассматривать структуру комплексов в то время, когда концепция четырехвалентности углерода была уже разработана и установлено образование в органических соединениях углерод-углеродных цепей. Эта концепция оказала заметное влияние на умы химиков того времени. Нет сомнения в том, что она повлияла и на Бломстранда, шведского профессора химии в Университете в Лунде, предложившего в 1869 г. для объяснения существования комплексов цепную теорию.
Так как в то время считали, что элементы имеют один тип валентных связей, Бломстранд и его студент Иергенсен (будущий профессор университета в Копенгагене) предположили, что кобальт(III) в своих комплексах может иметь только три связи. Поэтому для объяснения наличия еще шести дополнительных молекул аммиака в комплексе CoCl3*6NH3 они использовали цепную структуру (I). В соответствии с этой формулой три иона хлора отделены от атома кобальта на некоторое расстояние;
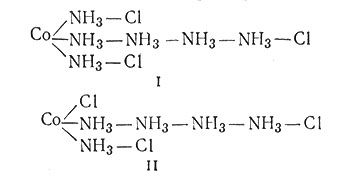
поэтому полагали, что они легко осаждаются в виде хлорида серебра при добавлении Ag+. Эта теория представляет строение CoCl3*5NH3 структурой II. В соответствии с этой формулой один ион хлора непосредственно соединен с атомом кобальта; поэтому полагали, что этот ион не ионизируется и сразу не осаждается в виде хлорида серебра. Структура III для CoCl3*4NH3 также соответствует опытным данным, подтверждающим, что в этом комплексе два иона хлора удерживаются прочнее, чем третий:
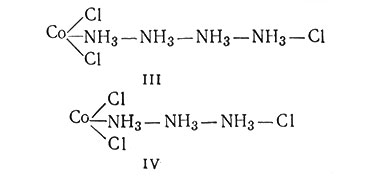
Следующий член этой серии CoCl3*3NH3 был представлен формулой IV. В соответствии с такой структурой этот комплекс должен вести себя аналогично CoCl3*4NH3. Профессору Иергенсену, очень способному экспериментатору, не удалось получить соединение CoCl3*3NH3. Однако вместо этого он приготовил аналогичный иридиевый комплекс IrCl3*3NH3. Раствор этого соединения не проводил электрический ток и не давал осадка при добавлении нитрата серебра. Так Иергенсену удалось показать, что его цепная теория не верна.
Координационная теория Вернера
Современному пониманию природы комплексов мы обязаны остроумному представлению, развитому Альфредом Вернером, профессором химии в Цюрихе, лауреатом Нобелевской премии 1913 г. В 1893 г., в возрасте всего лишь 26 лет, он предложил теорию, которую теперь обычно называют координационной теорией Вернера, ставшую ведущей в неорганической химии и в учении о валентности. Три наиболее важных положения этой теории следующие:
- Большинство элементов проявляет два типа валентности: а) главную валентность (------) и б) побочную валентность (________). В современной терминологии (а) соответствует степени окисления и (б) - координационному числу.
- Каждый элемент стремится насытить как главную, так и побочную валентности.
- Побочная валентность направлена к точно фиксированным положениям в пространстве. [Следует отметить, что это является основой стереохимии комплексов (гл. III).]
Сформулировав эти основные положения, нужно вернуться к описанным ранее экспериментальным фактам и посмотреть, как их объясняет координационная теория Вернера. Целесообразно вновь обратиться к хлорамминам кобальта(III). По этой теории первый член ряда CoCl3*6NH3 имеет строение V и формулу [Co(NH3)6]Cl3. Главная валентность, или степень окисления кобальта, равна 3. Три иона хлора насыщают главную валентность атома кобальта; ионы, нейтрализующие заряд иона металла, присоединены к нему за счет главной валентности. Побочная валентность, или координационное число (часто сокращенно обозначают К. Ч.), для Со(III) равна 6. Координационным числом называют число атомов или молекул, присоединенных непосредственно к атому металла. Молекулы аммиака используют побочную валентность. Говорят, что они координируются ионом металла; их называют лигандами. Лиганды (в данном случае молекулы аммиака) присоединены непосредственно к атому металла; они образуют координационную сферу металла. Ион кобальта(III) уже окружен шестью молекулами аммиака, так что ионы хлора не могут быть в координационной сфере, а следовательно, они находятся дальше от иона металла и не связаны с ним прочно. Таким образом, раствор комплекса проводит электрический ток за счет четырех ионов, и ионы хлора легко осаждаются ионами Ag+ в виде хлорида серебра.
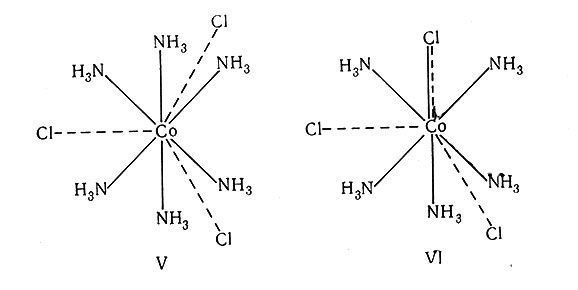
Вернер представил CoCl3*5NH3 формулой VI. Это согласуется с положением 2, утверждающим, что в комплексе главная и побочная валентности должны быть насыщены. В CoCl3*5NH3 для насыщения побочной валентности имеется только пять молекул аммиака, поэтому один ион хлора должен одновременно насыщать оба типа валентности. Связь такого лиганда с центральным атомом Вернер изображал комбинацией сплошной и пунктирной линий . Такой ион хлора трудно осаждается из раствора под действием иона серебра. Комплексный катион [Со(III)(NH3)5Cl]2+ имеет заряд 2+, так как Co3+ + Cl- = +3-1 = +2. Современная формула CoCl3*5NH3 имеет вид: [Co(NH3)5Cl]Cl2.
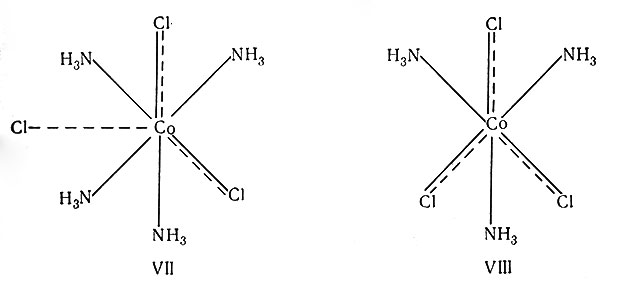
Распространение этой теории на следующий член ряда CoCl3*4NH3 приводит к формуле VII. Два иона хлора насыщают оба типа валентности - главную и побочную; следовательно, они прочно удерживаются в координационной сфере. Поэтому в растворе комплекс диссоциирует на два иона, Cl- и [Co(NH3)4Cl2]+.
Особое положение занимает следующий член ряда: CoCl3*3NH3. По теории Вернера его можно представить структурой VIII и формулой [Co(NH3)3Cl3]. В противоположность цепной теории, в соответствии с которой этот комплекс при диссоциации должен дать один ион хлора, теория Вернера предсказывает, что комплекс не будет диссоциировать в растворе. Полученные экспериментальные данные (табл. 3 и 4) показывают, что соединения типа [М(III)(NH3)3Cl3] не ионизированы в растворе. Этот факт доказывает несостоятельность цепной теории и подтверждает правильность координационной теории.
Третий постулат теории Вернера связан со стереохимией комплексов. Координационная теория правильно объясняет многие структурные особенности координационных соединений. Чрезвычайно важным явилось определение структуры комплексов с координационным числом 6. Изомерами называют соединения, отвечающие одной и той же формуле, но обладающие различным строением. До открытия рентгеновских лучей пространственную конфигурацию молекул определяли сравнением числа известных изомеров с числом теоретически возможных структур. Этим методом можно доказать, что некоторые структуры неверны, и получить свидетельство в подтверждение (но не в доказательство) правильности той или иной конфигурации.
Вернер с успехом использовал такой метод для демонстрации октаэдрической структуры комплексов с координационным числом 6. Метод основан на предположении, что шестикоординационная система имеет структуру, в которой шесть лигандов симметрично расположены на равном расстоянии от центрального атома. Далее, если предположить, что тремя наиболее вероятными структурами являются 1) плоская, 2) тригональная призма, 3) октаэдрическая (табл. 5), и сравнить число известных изомеров с числом теоретически предсказанных для каждой из этих структур, то для второго и третьего соединений (табл. 5) в случае плоской структуры и тригональной призмы должно быть по три изомера. В действительности же найдено, что комплексы этого типа существуют только в двух формах, что соответствует числу изомеров, теоретически возможных для октаэдрической структуры.
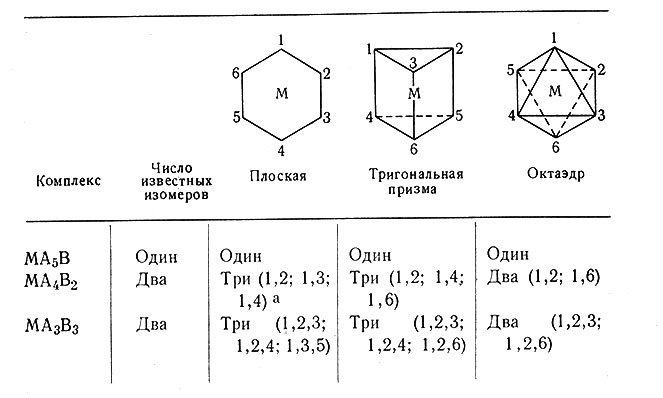
Таблица 5. Число известных изомеров в сравнении с числом теоретически возможных для трех различных структура
а (Числа указывают положение групп В.)
Эти результаты дают косвенное свидетельство, но не прямое доказательство, что плоская структура и структура тригональной призмы неверны. Неудача в получении третьего изомера еще не позволяет считать, что комплекс не может иметь эти две структуры; третий изомер может быть очень мало устойчивым и трудно выделяемым. Поскольку косвенное свидетельство дает только указание на то, что в действительности имеет место, ученый старается поставить эксперимент так, чтобы получить прямое свидетельство или доказательство. Вернер смог с определенностью показать, что плоская структура и структура тригональной призмы не могут быть приняты. Доказательство опиралось на то, что комплексы типа [М(АА)3] оптически активны, что будет рассмотрено в гл. III.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'