
I Введение. Историческое развитие
1. Введение
На ранней стадии изучения химии студент сталкивается с классом соединений, называемых координационными соединениями, комплексами металлов или просто комплексами. Это такие соединения, молекула или ион которых содержит центральный атом или ион, обычно металла, окруженный некоторым числом других ионов или молекул. Комплексы стремятся сохранить свою индивидуальность даже в растворе, хотя частично и способны к диссоциации. В зависимости от суммы зарядов центрального атома и окружающих его ионов и молекул комплекс может быть катионом, анионом или вообще не иметь заряда. Химия этого типа соединений и описана в данной книге.
Координационные соединения имеют большое значение в химической промышленности и в быту. В 1963 г. Нобелевская премия по химии была присуждена доктору Циглеру в Институте Планка в Германии и профессору Миланского университета Натта в Италии. Их исследования внесли существенный вклад в развитие метода полимеризации этилена при низком давлении, при помощи которого в настоящее время делают тысячи предметов домашнего обихода. Катализатор Циглера - Натта для полимеризации этилена представляет собой комплексное соединение алюминия и титана. Важность комплексов в жизни становится очевидной, если учесть, что хлорофилл, ответственный за фотосинтез в растениях, является комплексом магния, а гемоглобин, снабжающий кислородом клетки животных,- комплексом железа.
Без сомнения, студент уже встречался с координационными соединениями. Их широко используют в качественном анализе для разделения некоторых ионов металлов и для идентификации неизвестных ионов. В качестве примера можно привести опыт по обнаружению серебра. Если в растворе присутствуют ионы серебра, то добавление ионов хлора вызывает немедленное осаждение хлорида серебра. Этот осадок растворим в избытке водного раствора аммиака; но если к этому прозрачному раствору добавить азотной кислоты, белый осадок образуется вновь. Эти процессы обусловлены равновесиями (1) и (2):
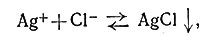
(1)
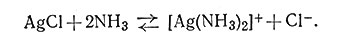
(2)
Белый осадок образуется, как видно по уравнению (1), потому что AgCl почти не растворимо в воде. Однако оно растворимо в избытке аммиака вследствие образования устойчивого комплексного иона [Ag(NH3)2]+ в соответствии с уравнением (2). Добавление избытка HNO3 к прозрачному раствору вызывает смещение равновесия (2) влево, и белый осадок AgCl появляется вновь; это обусловлено понижением концентрации NH3 вследствие его взаимодействия с ионами H+, ведущего к образованию NH+.
Образование комплексных ионов часто сопровождается резким изменением окраски. Хорошо известным примером является использование раствора CoCl2 в качестве бесцветных чернил. Написанное этим раствором не видно до тех пор, пока бумагу не нагреют. После нагревания появляется очень слабая голубая окраска, которая затем медленно исчезает. Явление, обусловливающее появление окраски, описано уравнением (3). Бледно-розовый акво-комплекс [Co(H2O)6]2+ при сильном разбавлении почти бесцветен
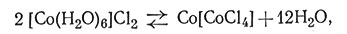
(3)
так что написанное им практически не видно. При нагревании вода испаряется и появляется голубой комплекс [CoCl4]2-. Его окраска достаточно интенсивна, чтобы легко прочитать написанное. На воздухе голубой комплекс медленно поглощает из атмосферы влагу, и вновь образуется первоначальный бесцветный комплекс, который делает написанное вновь невидимым.
Эти примеры служат иллюстрацией того, что координационные соединения часто встречаются в жизненной практике. До начала XX в. природа этих веществ не была понята и их называли "комплексными (сложными) соединениями". Этот термин сохранился и в настоящее время, но не по причине их сложности. Результатом глубокого изучения этих систем явилось такое расширение представлений о них, что они больше не считаются сложными. Вообще знание свойств комплексов необходимо для понимания химии металлов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'