
1. Двухэлектронная связь
В 1916 г. Льюис, профессор химии Калифорнийского университета в Беркли, постулировал, что связь между двумя атомами А и В осуществляется в результате совместного обладания парой электронов. Обычно каждый атом отдает в общее пользование один электрон. Эта двухэлектронная связь называется ковалентной связью. Основываясь на этих представлениях, он наглядно изобразил молекулы CH4 и NH3 следующим образом:
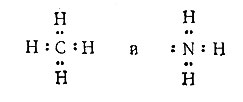
Этот способ изображения теперь называют льюисовской диаграммой молекулы.
Рассмотрение льюисовских диаграмм показывает, что молекулы CH4 и NH3 похожи в том отношении, что в них с каждым атомом водорода сочетаются два электрона (разделенная пара), в то время как с атомами С и N - восемь электронов. Важным и существенным отличием между ними является то обстоятельство, что одна электронная пара у атома азота не разделена с атомом водорода. Это позволяет молекуле аммиака реагировать, отдавая в общее пользование с каким-либо другим атомом свою свободную электронную пару. Возникающая связь осуществляется также электронной парой, т. е. является ковалентной связью, но так как оба электрона поставляются атомом азота, такую связь называют иногда координационной ковалентной связью.
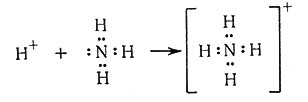
(1)
Реакция аммиака с кислотами с образованием аммонийных солей (1) приводит к возникновению координационной ковалентной связи. Тем не менее четыре N - Н связи в NH4+ эквивалентны. Это указывает на то, что различие между координационной и нормальной ковалентной связью незначительно. Молекула аммиака также может отдавать свои свободную электронную пару в совместное пользование не только иону водорода, но и другим ионам или молекулам. Если ион металла занимает место иона водорода, то образуется комплексный аммин металла [уравнения (2) - (4)]. Поскольку эти реакции в основном протекают в водном растворе, правильнее утверждать, что ионы металла
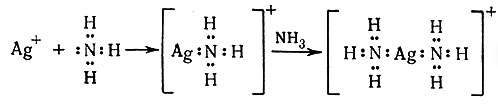
(2)
первоначально присутствуют в растворе в виде акво-комплексов, и координированные молекулы воды замещаются
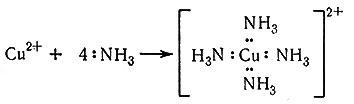
(3)
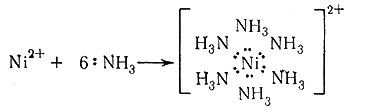
(4)
молекулами аммиака [уравнения (5) - (8)].

(5)

(6)

(7)

(8)
Подобные реакции являются по Льюису кислотно-основными реакциями. В соответствии с этой теорией кислотами называют вещества, молекулы которых способны присоединять электронные пары, а основаниями - вещества, способные их давать. Иногда для кислот и оснований используют термины акцептор и донор. В результате кислотно-основной реакции происходит образование координационных связей и координационного соединения (9).
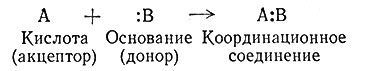
(9)
Теория Льюиса - более общая по сравнению с кислотно-основной теорией Аррениуса, в которой кислотой называется вещество, диссоциирующее в растворе с образованием ионов водорода, а основанием - вещество, дающее при диссоциации ионы гидроксила. Кислоты и основания Аррениуса по Льюису также кислоты и основания, как показывает реакция нейтрализации (13)
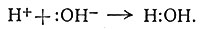
(10)
В соответствии с кислотно-основной теорией Льюиса к кислотам относятся ионы металлов, а также такие соединения, как BF3, AlCl3, SO3 и SiF4, которые могут принимать электронные пары. Соединения типа F3BNH3 и C5H5NSO3 обычно называют продуктами присоединения; они также являются примерами координационных соединений.
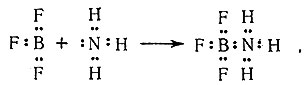
(11)
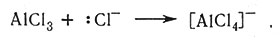
(12)
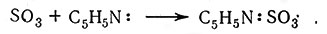
(13)
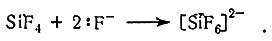
(14)
Лиганды отдают свои электронные пары в общее пользование с металлами и, таким образом, по Льюису сами являются основаниями. Примерами могут служить молекулы H2O:, :NH3, (C2H5)3P:, :СО и :NH2CH2CH2NH2, а также такие ионы, как
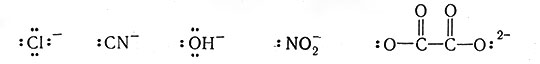
и
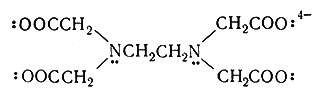
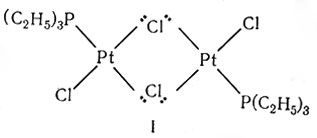
Теперь становится ясным, почему en и EDTA (табл. 6) способны реагировать соответственно как бидентатный и гексадентатный лиганды. Подобно этому атом, содержащий более одной неразделенной электронной пары, может служить мостиковым атомом (I).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'