
2. Эффективный атомный номер
Инертные газы (He, Ne, Ar, Kr, Xe и Rn) являются в высшей степени нереакционноспособными; только совсем недавно были получены некоторые соединения этих элементов. Давно уже было замечено, что соединения, в которых каждый атом путем разделения электронной пары с другими атомами окружает себя числом электронов, равным числу электронов в атомах инертных газов, являются очень устойчивыми. Профессор Оксфордского университета Сиджвик перенес это представление на комплексы металлов. Он утверждал, что центральный атом металла будет окружать себя таким числом лигандов, что общее число электронов в атоме металла будет таким же, как в атоме инертного газа. Число электронов в атоме металла-комплексообразователя называют его эффективным атомным номером, которому было дано обозначение ЭАН. Например, ЭАН для Со(III) в [Co(NH3)6]3+ легко вычислить следующим образом:
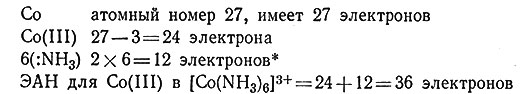
* (Считают, что каждый лиганд отдает два электрона в совместное владение с центральным атомом металла.)
Определенный подобным же образом ЭАН для других комплексов металлов во многих случаях равен атомному номеру инертного газа. Однако из этого правила имеется много исключений; например, для [Ag(NH3)2]+ и [Ni(en)3]2+ ЭАН соответственно равен 50 и 38. Если бы ЭАН центрального атома металла в действительности всегда был точно равен атомному номеру инертного газа, то можно было бы во всех комплексах оценивать координационное число ионов металла.
Класс соединений, наиболее часто подчиняющихся правилу ЭАН, включает карбонилы металлов и их производные. При помощи этого правила можно точно определить число групп СО в молекуле простейших карбонилов, а также предсказать, могут ли эти соединения существовать в виде мономеров. Например, ЭАН для металлов в соединениях Ni(CO)4, Fe(CO)5, Fe(CO)4Cl2, Mn(CO)5Br, CoNO(CO)3 и Fe(NO)2(CO)2 равен 36. Чтобы оценить ЭАН в этих системах, удобно принять, что СО, Cl- и Br- дают на образование связи два электрона, а NO - три электрона. Формула карбонила марганца (СО)5Mn - Mn(СО)5 является самой простой из возможных формул, если предположить, что каждый атом должен иметь ЭАН, равный 36:
Электроны каждого атома Mn = 25
Электроны от 5 групп (:СО) = 10
Электрон связи Mn - Mn = 1
36
Атом марганца при образовании связи с другим атомом марганца может получать один электрон. При этом каждый атом металла дает по одному электрону на связь, и, таким образом, каждый атом владеет совместно с другим атомом двумя электронами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'