
3. Электронная структура атома
Прежде чем продолжать обсуждение вопросов теории связи, необходимо кратко рассмотреть электронную структуру атома. Следует иметь в виду, что электроны в атоме последовательно занимают энергетические уровни. На первом уровне могут находиться максимально 2 электрона, на втором - 8, на третьем - 18 и на четвертом - 32 электрона. Главные уровни энергии от 1 до 7 делятся на подуровни s, p, d и f; электроны последовательно занимают незаполненные подуровни с наинизшей энергией. Во всех последующих рассуждениях принято допущение, что электроны находятся на уровне с наинизшей энергией.
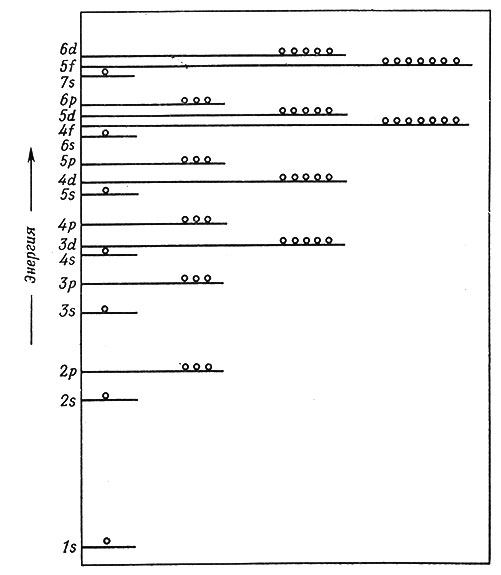
Рис. 1. Схема энергетических уровней орбит легкого атома. На схеме точно указаны относительные значения величин энергии уровней, а абсолютные значения искажены
На схеме энергетических уровней (рис. 1) видно, что в каждом главном уровне подуровень s характеризуется энергией, более низкой, чем подуровень p, подуровень p - более низкой, чем подуровень d, и, наконец, подуровень d более низкой, чем подуровень f. Схема указывает также, что подуровню 3d свойственна более высокая энергия, чем 4s, а 4f - более высокая, чем 6s; таким образом, подуровни одного главного уровня могут характеризоваться более высоким значением энергии по сравнению с энергией низшего подуровня следующего главного уровня.
Несмотря на то что величины энергии подуровней главного уровня всегда располагаются в таком порядке: s<p<d<f, их относительные энергии в различных главных уровнях находятся под влиянием окружения рассматриваемого атома и сильно зависят от его атомного номера. Так, в атоме калия подуровень 3d характеризуется более высокой энергией, чем 4s; в атоме скандия энергии подуровней 3d и 4s сравнимы по величине, а в атоме цинка 45-подуровень характеризуется более высоким значением энергии, чем 3d. Для приближенного нахождения электронных конфигураций атомов можно воспользоваться схемой, приведенной на рис. 1.
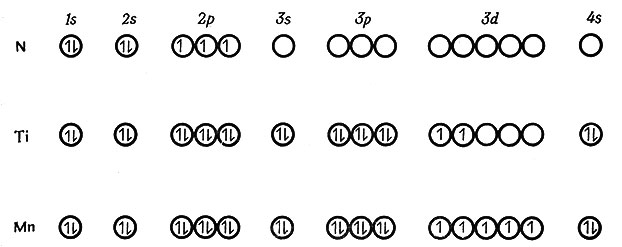
Рис. 2. Электронные структуры атомов N, Ti и Mn
На рис. 1 маленькими кружками изображены орбиты. Число орбит для каждого подуровня соответственно равно: для s = 1, для p = 3, для d = 5, для f = 7. На каждой орбите может быть максимум два электрона, и, таким образом, наибольшее число электронов каждого подуровня равно для s - 2, для p - 6, для d - 10 и для f - 14. Электроны заполняют каждый подуровень в соответствии с правилом Хунда, по которому на орбитах одного и того же подуровня должно быть наибольшее число неспаренных электронов. Это означает, что электроны последовательно добавляются на пустые орбиты, поскольку они отталкиваются друг от друга и предпочитают находиться на разных орбитах (как можно дальше один от другого). Электронные структуры N, Ti и Mn можно изобразить так, как показано на рис. 2. Электроны p-подуровня атома азота и d-подуровня атомов Ti и Mn неспарены. Нет необходимости выписывать все подуровни, как это сделано на рисунке. Обычно указывают только электроны, имеющиеся в атоме вне оболочки предшествующего инертного газа (валентные электроны), поскольку именно они участвуют в образовании химической связи. Наконец, следует заметить, что в дальнейшем удобнее перечислять 3d-подуровни перед 4s, a 4d- и 4f-подуровни перед 5s и т. д.
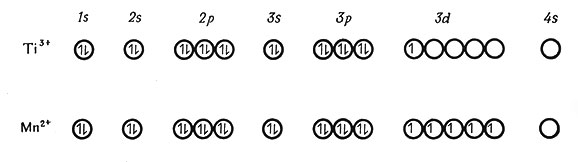
Рис. 3. Электронные структуры ионов Ti3+ и Mn2+
Рассмотрев электронные структуры атомов, необходимо остановиться теперь на электронных структурах ионов. Вообще при образовании положительных ионов электроны удаляются с орбит атома, соответствующих наиболее высокой энергии. В случае переходных металлов наибольшую энергию имеют внешние s-электроны, и, следовательно, атом теряет их первыми. Поэтому электронные структуры Ti3+ и Mn2+ можно представить так: (рис. 3).
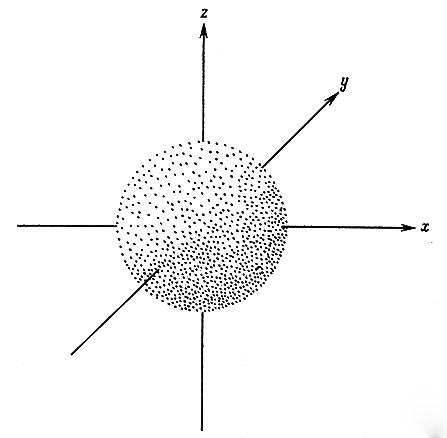
Рис. 4. Пространственная конфигурация s-орбиты
Далее необходимо знать форму электронных орбит. Под термином "форма орбиты" понимают геометрическую модель пространственной области наиболее вероятного нахождения электрона на этой орбите. Ограничимся s-, p- и d-орбитами, так как они чаще всего участвуют в образовании связи; при помощи f-орбит осуществляется электронная связь только у переходных элементов (редкоземельных элементов и актинидов). s-Орбита имеет сферическую симметрию (рис. 4); р-орбита - форму гантели, ориентированную вдоль одной из трех координатных осей. px-Орбита ориентирована вдоль оси х, py - вдоль оси y и pz - вдоль оси z (рис. 5).
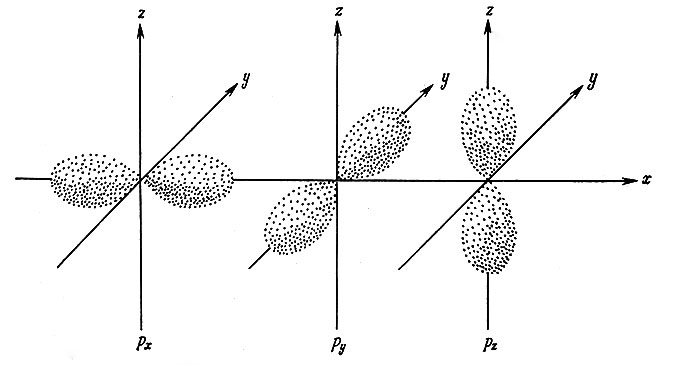
Рис. 5. Пространственные конфигурации p-орбит
Четыре из пяти d-орбит имеют форму клеверного листа, и одна - форму гантели с кольцом вокруг центра. Три клевероподобные орбиты dxy, dxz, dyz ориентированы соответственно в плоскостях xy, xz и yz так, что они располагаются между двумя осями; четвертая же dx2-y2 ориентирована в плоскости xy вдоль осей x и y (рис. 6).
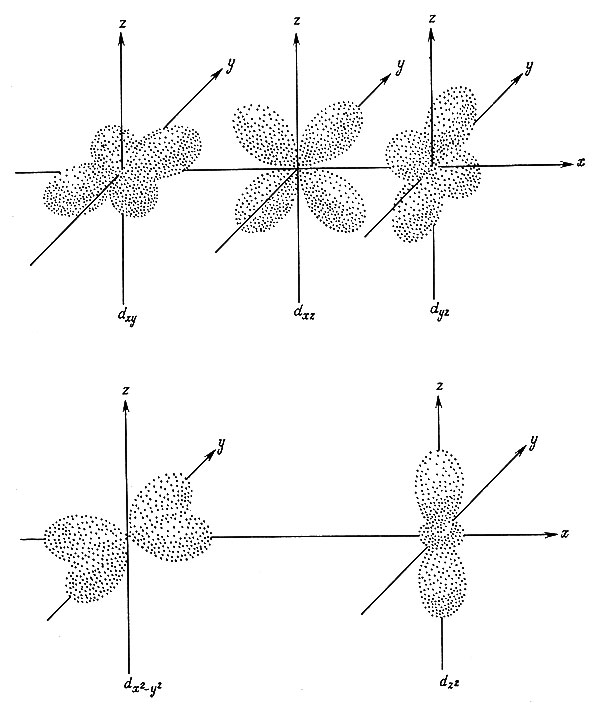
Рис. 6. Пространственные конфигурации d-орбит
Единственная орбита, имеющая форму гантели, ориентирована вдоль оси z. Чтобы понять теорию связи в комплексах металлов, очень существенно сохранить в памяти форму этих орбит в трехмерном пространстве.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'