
6. Теория молекулярных орбит
Теория молекулярных орбит (ТМО) становится все более популярной среди химиков. Она учитывает и ковалентный, и ионный характер химических связей, хотя специально об этом не упоминает. ТМО рассматривает распределение электронов в молекулах так же, как современная теория трактует распределение электронов в атомах. Во-первых, положения атомных ядер и орбит вокруг них считают определенными; эти молекулярные орбиты (МО) располагаются в области наиболее вероятного нахождения электрона в пространстве. Вместо того чтобы располагаться у одного атома, эти МО простираются во всей молекуле или в ее части. Расчеты формы МО были проведены только для простейших молекул.
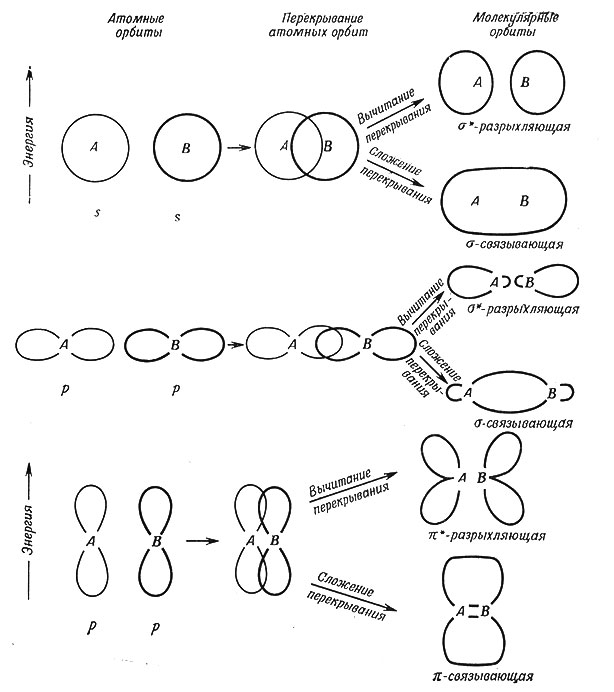
Рис. 16. Образование молекулярных орбит по методу ЛКАО
Поскольку расчет МО на основании общих принципов затруднителен, то обычно используют приближенный метод линейной комбинации атомных орбит (ЛКАО). Естественно, что МО молекулы должны напоминать атомные орбиты (АО) атомов, из которых составлена молекула. Исходя из известных форм атомных орбит, можно ориентировочно охарактеризовать формы МО. Линейные комбинации (сложение и вычитание) двух атомных s-орбит, дающие две молекулярные орбиты, приведены на рис. 16. Одна молекулярная орбита возникает от сложения перекрывающихся частей АО, другая - от их вычитания.
Молекулярная орбита, которая получается от сложения двух s-орбит, занимает пространство между двумя ядрами; ее называют связывающей МО; ей соответствует энергия, более низкая, чем каждой из двух s-AO, от которых она произошла. Молекулярная орбита, получающаяся путем вычитания перекрывающихся частей АО, не включает пространства между ядрами. Она имеет более высокую энергию, чем первоначальные АО, и называется разрыхляющей МО. Разность энергии связывающей и разрыхляющей МО можно оценить, если учесть, что электрон связывающей орбиты находится под воздействием обоих ядер, а электрон разрыхляющей МО находится под воздействием только одного ядра.
Комбинации атомных s-орбит дают молекулярные σ(сигма)-орбиты. Комбинация атомных р-орбит, как показано на рис. 16, может дать либо σ-, либо π(пи)-молекулярную орбиту. В случаеπ-МО в молекуле можно провести плоскость, проходящую через оба ядра, в которой вероятность нахождения электрона равна нулю. Электроны на π-МО находятся только выше или ниже оси связи.
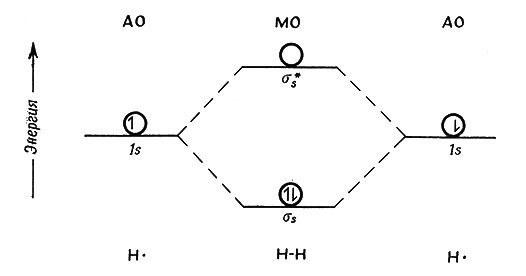
Рис. 17. Диаграмма уровней энергии молекулярных орбит молекулы водорода
Для иллюстрации использования ТМО можно рассмотреть диаграмму энергии МО для нескольких простых молекул. На рис. 17 показана диаграмма молекулы Н2. В отдельных атомах водорода на каждой атомной орбите находится один электрон. В молекуле Н2 оба электрона находятся на энергетически более низкой σ-связывающей МО. Молекула Н2 устойчивей, чем свободные атомы Н, так как оба электрона находятся в молекуле на орбите с более низкой энергией. Разница в энергии атомных орбит и связывающей молекулярной орбиты зависит от того, насколько атомные орбиты перекрываются в молекуле. Широкое перекрывание вызывает большое различие и, следовательно, сильную связь; малое перекрывание - малое различие; и в этом случае молекула будет характеризоваться значением энергии, лишь немного более низким, чем отдельные атомы.
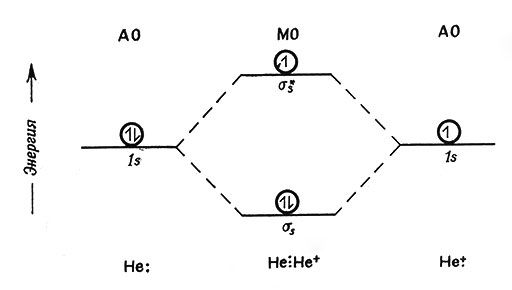
Рис. 18. Диаграмма уровней энергии молекулярных орбит дигелий-иона
Ион Не+2 (дигелий-ион) представляет собой трехэлектронную систему; диаграмма уровня энергии его МО показана на рис. 18. Поскольку на орбите может быть только два электрона, третий электрон должен идти на σ*-разрыхляющую МО. Этой орбите соответствует более высокая энергия, чем АО отдельных атомов Не; таким образом, помещение электрона на σ*-МО характеризуется потерей энергии вследствие образования менее устойчивой системы. Это согласуется с экспериментальным наблюдением, что энергия связи Не+2 равна только 57 ккал/моль по сравнению с 103 ккал/моль для молекулы Н2. Четырехэлектронная молекула He+2 не более устойчива, чем два свободных атома Не.
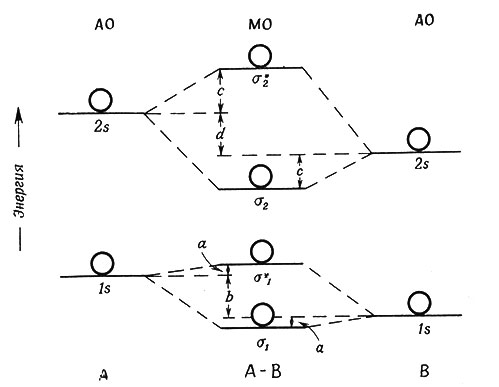
Рис. 19. Диаграмма уровней энергии молекулярных орбит молекулы АВ
Диаграмма уровней энергии МО в общем виде для. молекулы АВ показана на рис. 19. Для этой молекулы может быть неограниченное число МО, характеризующихся высокой энергией, так же как для атомов А и В может быть неограниченное число АО с высокой энергией; однако интерес вызывают орбиты с низкой энергией, на которых находятся электроны. Если имеют дело с двумя различными типами атомов, то энергии атомных орбит различны (например, 1s-орбитам А и В соответствуют различные значения энергии). У более электроотрицательного элемента атомные орбиты характеризуются более низдой энергией. Различие в энергии орбит атомов двух элементов (рис. 19, величины b и d) является мерой ионности связи. В молекуле H2 1s-орбитам двух атомов водорода соответствует одна и та же энергия, и, следовательно, связь не имеет ионного характера.
Большее различие в энергии двух АО, дающих при комбинации МО, характеризует более ионный характер связи. В молекуле АВ энергия σ1-МО близка к энергии 1s-AO атома В; это значит, что она имеет большее сходство с ls-орбитой В, чем с ls-орбитой атома А. Если атомы А и В предоставляют каждый по одному электрону для образования МО, то это приводит к переносу заряда от атома А к В, так как значение σ1 ближе к значению энергии атомной орбиты В, чем атомной орбиты А. Величины а и с интересны в другом отношении; они зависят от степени перекрывания атомных орбит А и В и являются мерой ковалентности связи. На рис. 19 а<с, и это значит, что степень перекрывания 1s-орбит атомов А и В в пространстве невелика, в то время как взаимодействие 25-орбит может быть более значительным, поскольку они простираются дальше от ядер. Величина энергии, выделяемая при образовании связи А - В, зависит от числа и энергии электронов, вносимых в молекулу атомами А и В. Табл. 8 иллюстрирует сказанное выше.

Таблица 8. Энергия, выделяющаяся при образовании молекулы АВа
а (Читатель сам может получить данные для случаев, не включенных в таблицу; см. рис. 19.)
Диаграммы уровней энергии МО для комплексов металлов значительно более сложны, чем для простых двухатомных молекул. Все же на диаграммах МО для [Со(NH3)6]3+ и [CoF6]3- рис. 20 можно обнаружить несколько хорошо известных особенностей. С левой стороны показаны 3d-, 4s- и 4р-атомные орбиты Со3+. АО с более высокой и более низкой энергией нас не интересуют. Поскольку присоединено шесть лигандов, то правая часть диаграммы несколько отличается от рассмотренных ранее. Показан только один уровень энергии, который участвует в образовании σ-связи. (Иногда используют более сложные диаграммы.) Так как все шесть лигандов одинаковы, этот уровень энергии соответствует энергии орбиты каждого лиганда.
![Рис. 20. Диаграмма уровней энергии МО высокоспинового комплекса [CoF><sub>6</sub>]<sup>3-</sup> и низкоспинового комплекса [Co(NH<sub>3</sub>)<sub>6</sub>]<sup>3+</sup>](pic/000072.jpg)
Рис. 20. Диаграмма уровней энергии МО высокоспинового комплекса [CoF6]3- и низкоспинового комплекса [Co(NH3)6]3+
Энергия орбит лиганда вообще ниже, чем энергия орбит металла, и потому связи имеют до некоторой степени ионный характер. Следовательно, связывающие МО более похожи на орбиты лиганда, чем на орбиты металла, и переход электронов металла на эти молекулярные орбиты приводит к переносу заряда от металла к лиганду. Две d-орбиты (eg-орбиты: dx2-y2 и dz2), 4s- и три 4р-орбиты ориентированы вдоль осей x, y и z, на которых расположены лиганды. Поэтому перекрывание орбит металла и лиганда приводит к образованию шести связывающих и шести разрыхляющих МО: σs(1), σp(3), σd(2), σ*d(2), σ*s(1), σ*p(3). t2g-Орбиты Idxy, dxz и dyz) не направлены к орбитам лиганда и, следовательно, не участвуют в образовании σ-связи. Их энергия не изменяется, и они называются несвязывающими орбитами.
Если электроны Со(III) и лигандов находятся на молекулярных орбитах комплекса, то заполнены шесть связывающих МО; это соответствует шести связям металл - лиганд. Оставшиеся электроны распределены среди несвязывающих (t2g-орбит) МО и σ*d-(разрыхляющих) молекулярных орбит. σ*d-МО являются результатом взаимодействия dx2-y2- и сгорбит металла и орбит лиганда, но поскольку σ*d-молекулярные орбиты по значению энергии ближе к dx2-y2- и dz2-орбитам металла, они отличаются от них незначительно. Поэтому размещение избытка электронов на t2g- и σ*d-молекулярные орбиты аналогично размещению их, предсказанному моделью кристаллического поля с тем же числом электронов, распределенных между t2g- и eg-орбитами.
Если различие в энергии Δ между несвязывающими t2g-орбитами и σ*d-MO мало, выполняется правило Хунда; [CoF6]3- представляет как раз такой случай; в нем d-электроны распределены по t42gσ*d2-орбитам. Наличие двух электронов на σ*d-орбите сокращает число электронов на связывающих σd-орбитах и, следовательно, ослабляет связь Со - F. Если Δ велико, как у [Со(NH3)6]3+, все электроны стремятся занять t2g-орбиты. Причины разделения энергии между t2g и σ*d или eg-орбитами различны в обеих теориях. Согласно теории кристаллического поля, расщепление является следствием электростатического отталкивания d-электронов от лигандов. Теория молекулярных орбит в основном приписывает расщепление образованию ковалентной связи. Чем больше перекрывание eg-орбит металла с орбитами лиганда, тем выше энергия σ*d-орбиты.
ТМО может объяснить влияние π-связей на устойчивость комплексов металлов и на величины расщепления кристаллическим полем, обусловленные лигандами. Поскольку количественная трактовка сравнительно сложна, здесь будет проведено только качественное объяснение. Ранее было указано, что сила ковалентного взаимодействия зависит от степени перекрывания атомных орбит двух связанных атомов. В предыдущих примерах было рассмотрено только σ-перекрывание. В [Fe(CN)6]4- и в большинстве других комплексов имеются одновременно σ- и π-связи (рис. 21). В σ-связи лиганд ведет себя как основание по Льюису и предоставляет электронную пару в общее владение на пустую eg- (на рис. 21, dx2-y2)-орбиту металла. В π-связи CN--HOH ведет себя как кислота по Льюису и принимает электроны с заполненной t2g-орбиты металла (на рис. 21 с dxy-орбиты). Наличие π-связи, также как и σ-связи, усиливает связь металл - лиганд и придает необычайную устойчивость иону [Fe(CN)6]4-. В оксианионах, таких, как MnO4-, σ- и π-связи также очень важны. В этом случае лиганд (кислород) предоставляет электроны для π-связи.
Большое кристаллическое поле, создаваемое CN-, СО и другими лигандами, образующими π-связи, можно объяснить таким же путем. t2g-Орбиты металла в октаэдрическом комплексе ориентированы прямо по π-связям (рис. 21). Как было отмечено ранее, t2g-орбиты направлены между лигандами и, следовательно, не могут образовать σ-связи. В π-связи с лигандами типа CN- t2g-электроны частично переносятся к лигандам. Этот процесс (связывающее взаимодействие) понижает энергию t2g-орбит. На рис. 8 видно, что процесс, понижающий энергию t2g-орбит, должен увеличивать Δ0.
![Рис. 21. σ- и π-Связи в комплексе [Fe(CN)><sub>6</sub>]<sup>4-</sup>. π-Связь образуется за счет использования заполненной d-орбиты иона Fe<sup>2+</sup> и пустой разрыхляющей π*-орбиты CN<sup>-</sup> (см. π<sup>*</sup> на рис. 16)](pic/000073.jpg)
Рис. 21. σ- и π-Связи в комплексе [Fe(CN)6]4-. π-Связь образуется за счет использования заполненной d-орбиты иона Fe2+ и пустой разрыхляющей π*-орбиты CN- (см. π* на рис. 16)
Все то, о чем говорилось выше, является упрощенным методом молекулярных орбит; он иллюстрирует лишь некоторые основные идеи и полезность теории. Теория молекулярных орбит очень эффективна для учета ионного и ковалентного вклада в связь металл-лиганд.
В заключение следует отчетливо представить себе, что все эти три теории в лучшем случае дают только хорошие приближения. Все три теории могут качественно объяснить много особенностей комплексов металлов, все три используются в настоящее время, и та или иная может быть удобна для данного случая. Наиболее гибкой и, возможно, наиболее близкой к истине является теория молекулярных орбит. К сожалению, она наиболее сложна и непригодна для наглядного представления химически связанных атомов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'