
1. Геометрия координационных соединений
Установлено, что комплексы металлов характеризуются большим разнообразием структур. Комплексы серебра часто линейны, комплексы бериллия обычно тетраэдрические; железо образует карбонильные соединения, имеющие структуру тригональной бипирамиды; комплексы кобальта(III) всегда октаэдрические, а тантал координирует вокруг себя восемь атомов фтора (рис. 22). Несмотря на то что для комплексов металлов было найдено множество различных координационных чисел и структур, чаще всего встречаются координационные числа четыре и шесть; обычно им соответствуют тетраэдрическая и плоская квадратная конфигурации (для координационного числа четыре) и октаэдрическая (для координационного числа шесть). При изучении комплексов металлов вскоре становится ясным, что наиболее часто встречается октаэдрическая конфигурация.
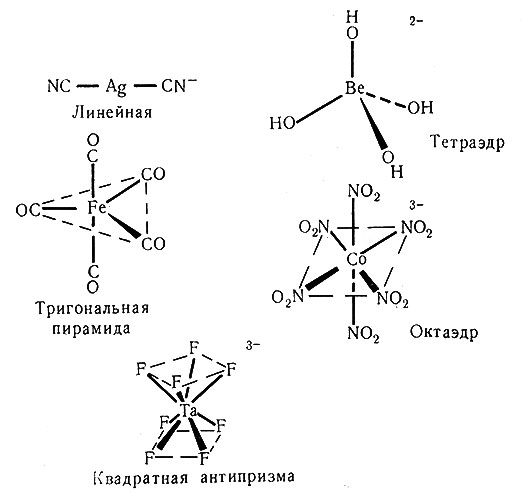
Рис. 22. Соединения, иллюстрирующие некоторые структуры комплексов металлов
Интересное и полезное приближение для предсказания структуры соединений с известным координационным числом центрального атома дает теория отталкивания валентных электронных пар (valence shell electron-pair repulsion) Жиллеспи и Ньюхольма.
Следствием этой теории является вывод, что комплексы с координационным числом четыре и шесть в основном имеют соответственно тетраэдрическую и октаэдрическую конфигурации. Комплексы переходных металлов иногда отклоняются от этого правила, и это отклонение можно отнести за счет имеющихся в них d-электронов. Теория кристаллического поля дает возможно наиболее простое объяснение влиянию rf-электронов на структуру комплексов.
Эта теория утверждает, что d-орбиты имеют специфическую геометрию и ориентацию в пространстве и что d-электроны находятся на орбитах, наиболее удаленных от атомных ядер. Наличие d-электронов в комплексах с координационным числом шесть и четыре вызывает искажение ожидаемых октаэдрической и тетраэдрической конфигураций. Искажение возникает потому, что лиганды избегают тех положений вокруг иона металла, в которых находятся d-электроны. Например, в комплексе [Ti(H2O)6]3+ вокруг иона Ti3+ имеется шесть молекул воды; следовательно, нужно ожидать октаэдрического распределения лигандов.
Далее необходимо рассмотреть влияние d-электронов металла на структуру. Если бы на внешнем d-подуровне имелось бы ноль, пять (неспаренных) или десять d-электронов, то последние не вызывали бы искажения. Заполненный d-подуровень с 10d-электронами имеет сферическую электрическую симметрию; заряженная частица (например, лиганд) на поверхности сферы с ионом металла в центре независимо от своего положения на этой сфере будет находиться под воздействием одинаковых электростатических сил. Если на каждой из пяти d-орбит имеется по одному электрону, то ион металла также будет иметь сферическую симметрию. Таким образом, в этих случаях d-электроны не будут оказывать влияния на положение занимаемое лигандом.
Комплекс [Ti(H2O)6]3+ имеет один d-электрон; этот электрон будет отталкивать лиганды, расположенные поблизости от него. Из теории кристаллического поля известно, что один электрон будет находиться на t2g-орбите, характеризующейся низкой энергией и простирающейся между лигандами H2O. Поскольку электрон находится на dxy-орбите, то следует ожидать искажения предсказанной октаэдрической структуры. Так как dxy-орбита лежит ближе всего к четырем лигандам в плоскости xy, то эти лиганды будут удаляться от иона металла; структура становится тетрагональной; два лиганда расположены ближе к иону металла, нежели четыре других. Того же эффекта следует ожидать, если электрон будет находиться на dxz- или dyz-орбитах. (Читатель может убедиться в этом сам.)
Так как t2g-орбиты направлены между лигандами, то влияние электрона, находящегося на одной из этих орбит, будет мало проявляться. Действительно, нет экспериментального доказательства тетрагонального искажения структуры комплекса [Ti(H2O)6]3+ или других d1-систем. В октаэдрических комплексах, содержащих два или три d-электрона, последние занимают t2g-орбиты, простирающиеся между лигандами. И хотя следует ожидать и для октаэдрических d2-систем небольшого искажения структуры, однако опять-таки это не подтверждается экспериментальными фактами. В октаэдрических d3-комплексах, таких, как [Cr(H2O)6]3+, на каждой t2g-орбите находится по одному электрону. Из рис. 6 видно, что каждый из шести октаэдрически расположенных лигандов будет лежать вблизи двух этих d-электронов и испытывать, следовательно, одинаковое отталкивание. В этом случае нельзя ожидать никакого искажения структуры, и оно не обнаружено экспериментально.
В комплексе [Cr(H2O)6]2+, который является высокоспиновой d4-системой, первые три электрона попадают на t2g-орбиты и не вызывают искажения октаэдрической структуры. Четвертый электрон попадает на одну из eg-орбит, направленную к лигандам. Если электрон находится на dz2-орбите, лиганды на оси z отталкиваются от него, если он расположен на dx2-y2-орбите, то отталкивание испытывают четыре лиганда в плоскости xy. Действительно, найдено, что d4-комплексы металлов с координационным числом шесть имеют искаженные структуры во всех изученных случаях. Например, в MnF3-6 каждый атом Mn(III) окружен шестью ионами F-, расположенными так, что четыре из них находятся ближе к иону Mn3+, чем два других (рис. 23).
Теперь следует рассмотреть искажение октаэдрических структур, вызываемое наличием 0, 1, 2, 3, 4, 5 (неспаренных) и 10d-электронов. Высокоспиновые d6-, d7-, d8- и d9-системы ведут себя аналогично соответственно d1-, d2-, d3- и d4-системам. (Первые пять электронов дают электронное облако сферической симметрии; остальные электроны вызывают искажение.) У d9-комплексов с координационным числом шесть замечено тетрагональное искажение структуры, как и у d4-комплексов. Самыми обычными примерами являются комплексы Cu(II). В комплексе [Cu(NH3)4]2+ тетрагональное] искажение настолько сильно, что в результате получается плоский квадратный комплекс. Однако следует отметить, что молекулы растворителя в растворах комплексов этого типа занимают положения над и под плоскостью; они находятся дальше от иона металла, чем группы, лежащие в плоскости. Искажение симметричных структур, являющееся следствием частичного заполнения электронных энергетических уровней (в этом случае d-подуровней), называется эффектом Яна - Теллера.
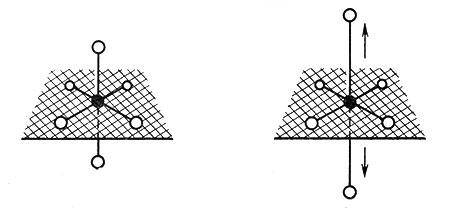
Рис. 23. Пример эффекта Яна-Теллера
Необходимо также рассмотреть искажения октаэдрических структур, наблюдаемые для низкоспиновых конфигураций. Низкоспиновые d6-системы подобны d3-комплексам. Шесть электронов полностью заполняют t2g-орбиты. Поскольку каждый из шести лигандов лежит в непосредственной близости от двух из этих орбит, искажения не происходит и наблюдается образование правильных октаэдрических структур. Низкоспиновые d8-комплексы подобны d4-системам. Последние два электрона попадают на одну eg-орбиту и сильно взаимодействуют с лигандами, обращенными в сторону этой орбиты. Заметное искажение заключается в том, что два лиганда значительно больше удалены от центрального иона, чем четыре других. Действительно, низкоспиновые d8-комплексы почти все без исключения плоские квадратные. Искажения октаэдрических комплексов, вызываемые наличием d-электронов указаны в табл. 9.

Таблица 9. Искажения октаэдрических структур, вызываемые наличием d-электронов
Итак, были рассмотрены искажения октаэдрических структур, вызываемые наличием d-электронов. Комплексы металлов могут иметь и тетраэдрическую структуру; однако они менее распространены, чем октаэдрические и искаженные октаэдрические конфигурации. Если атом металла окружен четырьмя лигандами, то нужно ожидать тетраэдрическую структуру. Наличие d-электронов может вызвать искажение тетраэдра.
Нужно отметить два исключения. Как видно из предыдущего, четырехкоординационные низкоспиновые d8-комплексы - плоские квадратные, как и четырехкоординационные d9- и высокоспиновые d4-комплексы. Комплексы металлов, содержащие 0,5 неспаренных и 10d-электронов, не вызывают искажений, как было отмечено ранее. Нахождение в октаэдрических комплексах электронов на орбитах, направленных между лигандами, не вызывает заметного искажения; таким образом, тетраэдрические d1-, d2-, d6- и d7-комплексы, по-видимому, являются неискаженными. В оставшихся тетраэдрических системах d3, d4, d8, и d9 проявляется заметный эффект Яна - Теллера. Однако примеров соединений этого типа имеется очень мало. Низкоспиновые тетраэдрические комплексы обсуждать не имеет смысла, так как примеров таких комплексов нет. Очевидно, расщепление кристаллическим полем (Δt) в тетраэдрических комплексах слишком мало, чтобы вызвать спаривание электронов.
Несмотря на то что предсказать стереохимию комплексных ионов с известным координационным числом центрального атома можно довольно точно, значительно труднее предсказать координационное число центрального атома. Электростатическое притяжение отрицательно заряженных лигандов (или полярных молекул) к положительно заряженному иону металла является причиной высоких координационных чисел. Теории ковалентных связей предсказывают, что большее число связей, образованных атомом элемента, приводит к большей устойчивости образующегося соединения.
Тенденции образования комплексов с высокими координационными числами противодействуют стерические факторы и электростатическое (или принцип Паули) отталкивание между лигандами. Простой схемы для каких-либо предсказаний с учетом этих критериев не существует. Однако следует отметить, что переходные элементы первого ряда часто имеют координационное число шесть. Координационное число четыре наблюдается главным образом в комплексах,содержащих некоторые большие анионы, такие, как Cl-, Br-, I- и O2- или объемистые нейтральные молекулы. Переходные элементы второго и третьего ряда проявляют такие высокие координационные числа, как восемь.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'