
5. Другие виды изомерии
Для координационных соединений известно, кроме пространственной и оптической, еще несколько других типов изомерии. Часто они встречаются только в этом классе соединений. Чтобы иллюстрировать каждый тип изомерии, ниже приведены конкретные примеры. В основном природа изомерии достаточно очевидна из примеров и не требует подробного обсуждения.
Координационная изомерия
Для соединений, имеющих комплексные катионы и анионы, возможны координационные изомеры, когда в соединении имеют место две различные комбинации: [MAn][M'Xm] и [М'Аn][МХm]. Некоторые примеры такой изомерии приведены ниже:
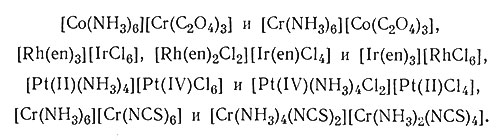
Особый вид координационной изомерии включает различное положение лиганда в мостиковом комплексе. Иногда его называют координационной изомерией положения. Конкретным примером являются следующие изомеры:
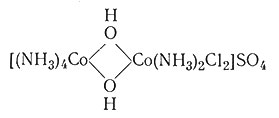
и
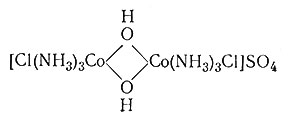
Ионизационная изомерия
Это название применяют для описания изомеров, которые дают в растворе различные ионы. Классическим примером является пурпурный комплекс [Co(NH3)5Br]SO4 и красный [Co(NH3)5SO4]Br; эти комплексы в растворе при диссоциации образуют соответственно сульфат- и бромид-ионы. Ниже приведено два примера из большого числа изомеров этого типа:
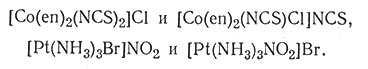
Подобными этим соединениям являются изомеры, получающиеся заменой координированных групп молекулой воды при гидратации. Этот тип изомерии называют иногда гидратной изомерией. Наиболее хорошо известными примерами являются три соединения [Cr(Н2O)6]Сl3, [Cr(Н2O)5Сl]Сl2*Н2O и [Cr(Н2O)4Сl2]Сl*2Н2O; они содержат соответственно шесть, пять и четыре координированные молекулы воды. Эти изомеры заметно различаются по физическим и химическим свойствам. Известны также другие изомеры этого типа:
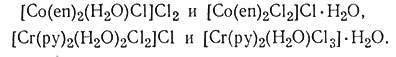
Изомерия связей
Изомерия связей может возникнуть в том случае, когда монодентатный лиганд имеет два разных атома, способных к координации. Связь между металлом и лигандом в одном изомере осуществляется через один атом лиганда, а в другом - через другой. Давно известно, что нитрит-ион в комплексах кобальта(III) может присоединяться либо через азот, Со - NO2 (нитро), либо через кислород Со-ONO (нитрито). Нитрито-комплексы кобальта(III) неустойчивы и в результате перегруппировки образуют более стабильные нитро-изомеры. Недавно проведенными исследованиями было показано, что аналогичные изомеры можно получить для комплексов Rh(III), Ir(III) и Pt(IV). Приведенные ниже комплексы являются примерами такой изомерии:
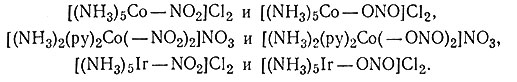
Все лиганды, кроме NO-2>, проставлены слева от атома металла, чтобы подчеркнуть, как нитрит-ион связан с атомом металла.
Большое число других лигандов потенциально способно образовать изомеры связей. Теоретически для этого требуется, чтобы лиганд имел два разных атома с неразделенными электронными парами. Таким образом тиоцианат-ион 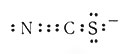 может взаимодействовать с атомом металла либо через атом азота, М - NCS, либо через атом серы, М - SCN. Встречаются оба вида взаимодействия, но в конкретной системе происходит образование либо одной, либо другой формы. Обычно первый ряд переходных элементов взаимодействует через азот, в то время как второй и третий ряды (в частности, платиновые металлы) взаимодействуют через серу. Совсем недавно удалось приготовить следующие изомеры этого типа:
может взаимодействовать с атомом металла либо через атом азота, М - NCS, либо через атом серы, М - SCN. Встречаются оба вида взаимодействия, но в конкретной системе происходит образование либо одной, либо другой формы. Обычно первый ряд переходных элементов взаимодействует через азот, в то время как второй и третий ряды (в частности, платиновые металлы) взаимодействуют через серу. Совсем недавно удалось приготовить следующие изомеры этого типа:
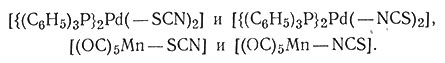
Другие лиганды, способные образовать изомеры связи, приведены ниже:
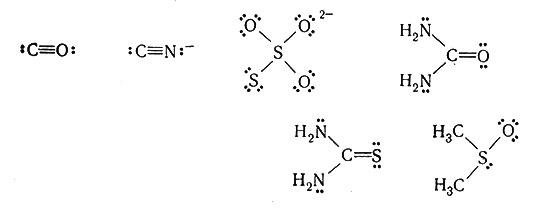
В карбонилах металлов, как и в комплексных цианидах, металл связан всегда с углеродом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'