
V. Устойчивость комплексных ионов
Чтобы понять поведение ионов металлов в растворах, нужно знать природу и устойчивость комплексов, которые могут образовать эти ионы с растворителем и с возможными лигандами, содержащимися в растворе. Исследования в этой области приводят к получению данных, необходимых для более глубокого понимания факторов, обусловливающих устойчивость комплексов. Найдено много важных практических применений этих сведений. Так, при качественном анализе некоторые осадки растворяют добавлением к ним соответствующего комплексующего агента. Применение тиосульфата Na2S2O3 для фиксирования в фотопроцессе эффективно потому, что галогенид серебра, входящий в состав эмульсии пленки, растворяется за счет образования устойчивого и растворимого в воде комплекса [Ag(S2O3)2]3-. Добавление комплексующих агентов к жесткой воде приводит к образованию устойчивых и растворимых комплексов тех ионов металлов, которые определяют жесткость воды (например, комплекса кальция), чем предотвращается образование нерастворимых солей металлов с обычным мылом.
![Рис. 30. Зависимость содержания Cu><sup>2+</sup> (%) в растворах в виде различных амминных комплексов от концентрации свободного аммиака. (Например, при концентрации свободного NH<sub>3</sub> 1,0*10<sup>-2</sup>M в растворе 65% Cu<sup>2+</sup> находится в виде [Cu(NH<sub>3</sub>)<sub>4</sub>(H<sub>2</sub>O)<sub>2</sub>]<sup>2+</sup>, 30% - [Cu(NH<sub>3</sub>)<sub>3</sub>(H<sub>2</sub>O)<sub>3</sub>]<sup>2+</sup> и 5% в виде [Cu(NH<sub>3</sub>)<sub>2</sub>(H<sub>2</sub>O)<sub>4</sub>]<sup>2+</sup>)](pic/000185.jpg)
Рис. 30. Зависимость содержания Cu2+ (%) в растворах в виде различных амминных комплексов от концентрации свободного аммиака. (Например, при концентрации свободного NH3 1,0*10-2M в растворе 65% Cu2+ находится в виде [Cu(NH3)4(H2O)2]2+, 30% - [Cu(NH3)3(H2O)3]2+ и 5% в виде [Cu(NH3)2(H2O)4]2+)
Если к раствору соли меди(II) добавить аммиак, то быстро происходит реакция замещения воды (координированной ионом металла) аммиаком. Несмотря на то что обычно продукт этой реакции представляют как [Cu(NH3)4]2+, в действительности же образуется много соединений; относительное количество каждого вида комплексов зависит от концентраций иона меди и аммиака (1-4). На рис. 30 графически показана зависимость содержания в растворе каждого вида аммина меди(II) от концентрации свободного аммиака. На основании этих данных можно сделать вывод, что [Cu(NH3)4]2+ наиболее важный комплекс, поскольку он является преобладающим в растворах с концентрацией свободного аммиака 0,01-5 М. Однако вне этого интервала концентраций в растворе в большом количестве содержатся другие аммины.
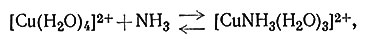
(1)
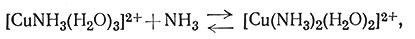
(2)
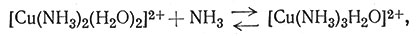
(3)
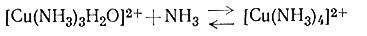
(4)
Подходя строго статистически, следует ожидать, что соотношение чисел молекул H2O и NH3 в комплексе будет таким же, как и в растворе; так, если раствор содержит одинаковое число молекул NH3 и H2O, преобладающим комплексом в растворе должен быть [Cu(NH3)2(H2O)2]2+. Однако такого статистического распределения лигандов не обнаружено. Ионы металла оказывают заметное предпочтение некоторым лигандам; например, ион меди(II) координирует молекулы NH3 охотнее, чем молекулы H2O. Тем не менее статистическое рассмотрение также важно тогда, когда при увеличении концентрации NH3 получаются комплексы меди(II), содержащие большое число координированных молекул аммиака.
В некоторых случаях предпочтение, оказываемое ионами металла некоторым лигандам, понятно; действительно, положительные ионы металла предпочтут лиганды-анионы нейтральным или положительно заряженным лигандам. Однако вообще факторы, определяющие, какой лиганд будет координироваться лучше данным ионом металла, многочисленны, сложны и не всегда понятны. В этой главе будут рассмотрены некоторые из этих факторов.
Поведение иона металла в растворе зависит от природы окружающих его групп (лигандов). Число и тип таких групп нельзя предсказать статистическим методом. Следовательно, для установления состава координационной сферы ионов металлов в растворе, содержащем большое число возможных лигандов, необходимо провести много исследований. Собранную при этих исследованиях информацию удобно выразить константами устойчивости. Эти константы аналогичны известным выражениям, использованным для описания ионизации кислот и оснований [уравнения (5) и (6)]*.
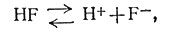
(5)
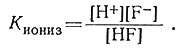
(6)
* (Квадратные скобки использованы в уравнении (6) для обозначения концентраций. Таким образом, обозначение [А] указывает концентрацию А в молях на литр.)
Действительно, комплексом в широком смысле называют частицу, образованную при ассоциации двух или более простых видов частиц, каждый из которых способен существовать независимо. В этом смысле кислота - комплекс Н+ и аниона. Константа ионизации является частным случаем константы устойчивости (фактически константы нестойкости). Формулировка и применение констант устойчивости приведено в разд. 1 данной главы.
При рассмотрении поведения координационных соединений в растворах обычно предполагают, что растворителем является вода; но некоторые координационные соединения растворяются в неводных растворителях, которые в последнее время стали широко применять. В этих растворителях ионы металла окружены молекулами растворителя, и реакция комплексообразования заключается в замене молекул растворителя другими лигандами. По существу, равновесие в неводных растворителях аналогично равновесию в водных растворах. Ограниченная растворимость ионов в большинстве неводных растворителей, трудности, связанные с недостаточной диссоциацией солей (спаривание ионов) в них, и удобство водных систем приводят к тому, что большинство исследований равновесий проводят в водных средах. Ниже будут рассмотрены равновесия в водной среде; кроме того, с некоторыми изменениями аналогичная трактовка будет применена к другим растворителям.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'