
1. Константы устойчивости
Установлено, что в реакционной смеси при равновесии и определенной температуре произведение активностей веществ, получившихся в результате реакции, деленное на произведение активностей исходных веществ, является постоянной величиной, называемой константой равновесия γ данной реакции (7).
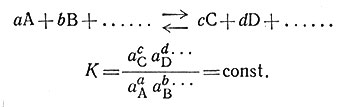
(7)
Активность вещества А равна произведению его концентрации на коэффициент активности γА
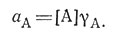
Коэффициент активности в очень разбавленных растворах равен единице, и в этих условиях концентрация и активность численно равны между собой. В 0,01-5 М растворах, чаще всего используемых в лабораториях, коэффициенты активности меньше единицы, а, следовательно, активности меньше, чем концентрации.
Последний факт можно истолковать как указание на то, что вещества не могут взаимодействовать независимо друг от друга, поскольку каждое из них находится под влиянием других растворенных веществ. Следовательно, их эффективная концентрация уменьшается. Однако в дальнейшем в выражениях констант равновесия активность часто будет заменена на концентрацию. Нужно учесть, что такая замена влечет за собой предположение о равенстве коэффициента активности единице, что будет точно соблюдаться только в очень разбавленных растворах.
Константа равновесия полезна тем, что она дает много сведений о равновесии. Например, константа равновесия реакции (8) была измерена в 0,128 М растворе HClO4 и оказалась равной 234. Из этого числового значения можно определить концентрации Fe3+, NCS- и Fe(NCS)2+ в растворе,
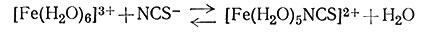
(8)
если концентрации двух других ионов известны*. Более важно вычисление концентрации всех трех компонентов в растворе, полученном при добавлении к 0,0100 М раствору Fe3+ в 0,128 М HClO4 тиоцианата калия KNCS, с таким расчетом, чтобы общая концентрация свободного и закомплексованного иона тиоцианата равнялось 0,0100 М**.

* (Fe3+ и FeNCS2+ использованы вместо [Fe(H2O)6]3+ и [Fe(H2O)5NCS]2+. Следует учесть, что все ионы в растворе гидратированы.)
** (Хлорная кислота (HClO4) добавлена для предотвращения кислотной диссоциации гидратированного иона Fe3+ (9)
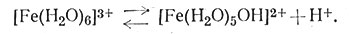
(9)
)
Такое вычисление дает только приблизительный ответ, так как при этом не учитывалось образование таких комплексов, как [Fe(NCS)2]+. Знание величин констант равновесия в растворах, содержащих ионы металла и лиганды, позволяет вычислить концентрации всех компонентов в растворе.
Комплексы металлов образуются в растворе ступенчато, и для каждой ступени можно написать константу равновесия [уравнения (10) и (11)].
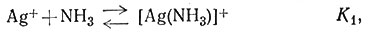
(10)
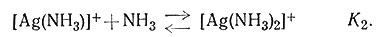
(11)
Молекулы воды, образующие гидратную оболочку иона металла в водном растворе, иногда опускают при написании уравнений реакций, так как часто число координированных молекул воды неизвестно. Больше того, воду, участвующую в реакции, никогда не включают в константу равновесия. Активность чистой воды по условию принята за единицу (несмотря на то, что ее концентрация равна 55,6 М); из этого следует, что в разбавленных растворах активность воды близка к 1.
Константы равновесия K1 (12) и K2 (13) называют последовательными константами устойчивости.
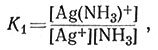
(12)
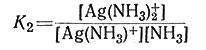
(13)
Их называют константами устойчивости потому, что большей величине константы соответствует большая концентрация комплекса при равновесии. Константа кислотной диссоциации является константой нестойкости (14), потому что она описывает диссоциацию кислоты (комплекса).
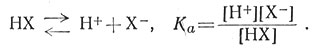
(14)
Константа устойчивости - обратная величина константы нестойкости; она является мерой степени ассоциации и применяют ее обычно для описания равновесия образования комплекса.
Второй также используемый вид констант равновесия называют общей константой устойчивости β (15).
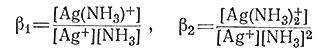
(15)
Так как K и β описывают одну и ту же систему, они должны быть связаны друг с другом (16).
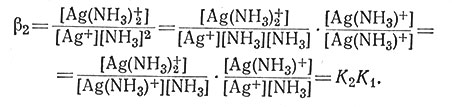
(16)
Из уравнения (15) видно, что β1 = K1, а из уравнения (16) следует, что β2 = K1K2. В общем виде βn = K1K2...Kn.
Числовое значение константы устойчивости зависит от относительных концентраций веществ при равновесии. Высокая величина константы устойчивости указывает на то, что концентрация комплекса значительно выше концентраций свободных составных его частей. Говорят, что комплекс устойчив, если константа равновесия, описывающая его образование, велика. В гл. VI будет показано, что это требование не означает, что соединение должно медленно реагировать, или что лиганды будут сопротивляться их замене не водой, а другими лигандами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'