
2. Факторы, влияющие на устойчивость комплексов
Устойчивость комплекса определяется величиной константы равновесия его образования. На языке термодинамики константа равновесия реакции является мерой выделившейся в реакции теплоты и изменения энтропии при реакции. Большее количество выделившейся теплоты приводит к образованию более устойчивых продуктов реакции. Энтропия системы является мерой беспорядка; больший беспорядок относительно исходных веществ, обусловленный образованием продуктов реакции, приводит к увеличению энтропии при реакции и к большей устойчивости конечных продуктов. Табл. 10 суммирует влияние теплоты реакции и изменение энтропии на устойчивость продуктов реакции. Теперь нужно рассмотреть отдельно влияние обоих факторов на устойчивость образующегося комплекса.
![Таблица 10. Факторы, увеличивающие устойчивость комплекса [ML><sub>x</sub>]<sup>n+</sup> и величину β](pic/000200.jpg)
Таблица 10. Факторы, увеличивающие устойчивость комплекса [MLx]n+ и величину β
Относительная устойчивость многих комплексов становится понятной при использовании простой электростатической модели. Предсказания этой модели связаны главным образом с выделившейся при образовании комплекса теплотой. Хорошо известно, что одноименно заряженные частицы отталкиваются, а противоположно заряженные притягиваются. Кроме того, отталкивание и притяжение зависят от расстояния между центрами частиц и возрастают при их сближении.
Таким образом, следует предположить, что наиболее устойчивыми будут те комплексы, которые состоят из противоположно заряженных ионов; более того, чем больше заряд и чем меньше размер иона, тем устойчивее образуется комплекс. Маленькие ионы образуют более устойчивый комплекс потому, что их центры могут ближе находиться друг к другу. С этой точки зрения устойчивость комплексов возрастает с увеличением заряда иона металла. Это положение иллюстрирует ряд устойчивости гидроксо-комплексов*.
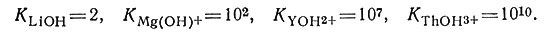
* (В этой книге приведены константы устойчивости (если не указано особо) для 25°. Поскольку литературные данные часто сильно расходятся, то указана только одна значащая цифра.)
Устойчивость комплексов ионов металлов, имеющих одинаковый заряд, увеличивается с уменьшением ионного радиуса. Константы устойчивости МОН+ для щелочноземельных металлов иллюстрируются следующим рядом:
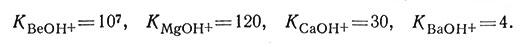
Из этих данных видно, что константы устойчивости YOH2+ и ВеОН+ одного порядка. Таким образом, очень небольшой катион, имеющий заряд 2+, может образовать комплекс с устойчивостью, сравнимой с устойчивостью большего, более высоко заряженного катиона.
Удобным критерием для оценки комплексообразующей способности ионов металлов является величина отношения заряда к радиусу. Табл. 11 иллюстрирует связь между отношением заряда к радиусу иона и устойчивостью образуемого им гидроксо-комплекса. Из табл. 11 видно, что заряд иона металла более существен, чем ионный радиус, но все же предсказание устойчивости часто может быть сделано этим способом.
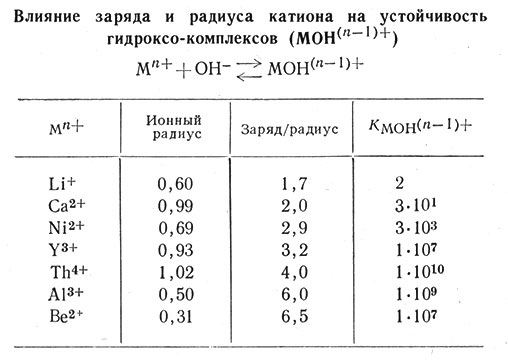
Таблица 11. Влияние заряда и радиуса катиона на устойчивость гидроксо-комплексов (МОН(n-1)+)
Устойчивость высокоспиновых комплексов двузарядных М2+-ионов в ряду от Mn2+ до Zn2+ с одним и тем же лигандом часто изменяется в следующем порядке: 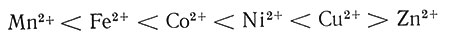 (см. рис. 31).
(см. рис. 31).
Эта последовательность, иногда называемая естественным рядом устойчивости, относительно хорошо согласуется с концепцией о влиянии отношения заряда к радиусу, так как радиусы ионов изменяются в этом же ряду в такой последовательности: 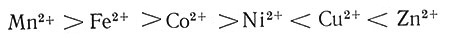 . Изменение размера катиона и ряд устойчивости образуемых комплексов можно объяснить при помощи понятий энергии стабилизации кристаллическим полем (ЭСКП) (разд. 5 гл. II). Высокоспиновые комплексы этих шести металлов имеют большей частью октаэдрическую структуру, за исключением комплексов Cu2+, которые, как уже было отмечено, образуют тетрагонально искаженные октаэдры. В октаэдрическом кристаллическом поле d-электроны на трех t2g-орбитах имеют более низкие значения энергии, чем d-электроны, находящиеся на двух еg-орбитах (см. рис. 8). t2g-Орбиты характеризуются энергией на 0,4Δ0 меньше, a eg - на 0,6Δ0 больше, чем гипотетическая пятикратно вырожденная d-орбита, имевшаяся у атома металла до расщепления кристаллическим полем. Если поместить электрон на t2g-орбиту, а не на одну из пяти вырожденных d-орбит, то величина стабилизации равна 0,4Δ0. Можно сказать, что система благодаря расщеплению кристаллическим полем сохранила 0,4Δ0 энергии и что энергия стабилизации кристаллическим полем равна 0,4Δ0. Значения энергии для октаэдрических комплексов, содержащих различное число d-электронов, приведены в табл. 7.
. Изменение размера катиона и ряд устойчивости образуемых комплексов можно объяснить при помощи понятий энергии стабилизации кристаллическим полем (ЭСКП) (разд. 5 гл. II). Высокоспиновые комплексы этих шести металлов имеют большей частью октаэдрическую структуру, за исключением комплексов Cu2+, которые, как уже было отмечено, образуют тетрагонально искаженные октаэдры. В октаэдрическом кристаллическом поле d-электроны на трех t2g-орбитах имеют более низкие значения энергии, чем d-электроны, находящиеся на двух еg-орбитах (см. рис. 8). t2g-Орбиты характеризуются энергией на 0,4Δ0 меньше, a eg - на 0,6Δ0 больше, чем гипотетическая пятикратно вырожденная d-орбита, имевшаяся у атома металла до расщепления кристаллическим полем. Если поместить электрон на t2g-орбиту, а не на одну из пяти вырожденных d-орбит, то величина стабилизации равна 0,4Δ0. Можно сказать, что система благодаря расщеплению кристаллическим полем сохранила 0,4Δ0 энергии и что энергия стабилизации кристаллическим полем равна 0,4Δ0. Значения энергии для октаэдрических комплексов, содержащих различное число d-электронов, приведены в табл. 7.
![Рис. 31. Логарифмы констант устойчивости для серии комплексов [ML><sub>6</sub>]<sup>2+</sup>, предсказанные теорией кристаллического поля. Если не пользоваться теорией кристаллического поля, то эти значения должны укладываться на пунктирную прямую. Экспериментальные данные, отмеченные кружками, показывают два максимума](pic/000206.jpg)
Рис. 31. Логарифмы констант устойчивости для серии комплексов [ML6]2+, предсказанные теорией кристаллического поля. Если не пользоваться теорией кристаллического поля, то эти значения должны укладываться на пунктирную прямую. Экспериментальные данные, отмеченные кружками, показывают два максимума
На рис. 31 приведена относительная устойчивость высокоспиновых октаэдрических комплексов [M(II)L6] переходных элементов первого ряда, предсказанная теорией кристаллического поля. Системы с тремя и восемью d-электронами будут более устойчивы по сравнению со своими соседями, так как они характеризуются самыми большими значениями энергии стабилизации. При переходе от комплексов Са2+ к комплексам Zn2+ наблюдается общее увеличение устойчивости, что происходит в результате уменьшения в этой же последовательности радиуса ионов М2+. Порядок устойчивости, предсказанный теорией кристаллического поля и приведенный на рис. 31, соответствуют естественному ряду устойчивости комплексов этих металлов, за исключением меди Cu2+, и, таким образом, этот ряд можно объяснить стабилизацией кристаллическим полем. Исключение для Cu2+ не совсем понятно, но это конечно связано с тем, что комплексам Cu2+, чтобы достигнуть максимальной энергии стабилизации кристаллическим полем, необходимо иметь искаженную октаэдрическую структуру.
Электростатическое влияние заряда и размеров лиганда на устойчивость комплексов также очень важно. Например, небольшие F--ионы образуют более устойчивые комплексы с Fe3+, чем большие хлорид-ионы:
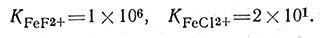
Однако большинство лигандов состоит из нескольких атомов; поэтому трудно определить эффективный радиус лиганда, а следовательно, и применить критерий его размера. Интересно отметить, что большой перхлорат-ион ClO-4, имеющий заряд 1-, проявляет очень слабую тенденцию к комплексообразованию с металлами, что находится в соответствии с электростатической точкой зрения.
К числу лигандов, имеющих важное значение в химии комплексных соединений, относятся и нейтральные молекулы (H2O, NH3, H2S и т. д.). С точки зрения электростатики эти лиганды связываются с ионами металла за счет притяжения между отрицательно заряженным концом диполя лиганда и катионом металла (I). Более полярный лиганд будет сильнее связан с ионом металла. Вода - самый полярный из обычных лигандов, и, следовательно, можно ожидать образования акво-комплексов металлов, более устойчивых, чем комплексы с другими нейтральными лигандами. Тот факт, что вода - самый лучший растворитель для многих солей, частично является следствием образования устойчивых акво-комплексов с ионами металлов.
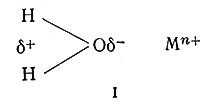
Было обнаружено, что большая основность лиганда приводит к образованию им более прочных комплексов. Основность молекулы является мерой устойчивости "комплекса", который эта молекула образует с Н+. Вполне естественно, что лиганды, прочно связывающие Н+, будут также и с ионом металла давать устойчивые комплексы. С этой точки зрения F- будет давать более устойчивые комплексы, чем Cl-, Br- и I-, a NH3 будет лучшим лигандом, чем H2O, которая в свою очередь будет лучше, чем HF. Предсказанное подтверждается для щелочных, щелочноземельных металлов и для других электроположительных металлов, таких, как первый ряд переходных элементов, а также для лантанидов и актинидов. Эти металлы часто называют металлами класса а.
Описанный простой электростатический подход удачно объясняет наблюдаемую опытным путем устойчивость многих комплексов металлов, а также может предсказать устойчивость других соединений. В частности, он оказывается эффективным для комплексов ионов металлов класса а. В комплексах, образованных ионами металлов класса б - ионами более электроотрицательных элементов, таких, как Pt, Au, Hg, Pb и некоторых более легких переходные металлов с низкими степенями окисления, электростатический подход тоже важен, однако значительную роль играют и другие факторы, в частности влияние кристаллического поля на образование ковалентных связей. Например, Со2+, Ni2+ и Cu2+ предпочтительно образуют комплекс с NH3, а не с H2O. Это отчасти обусловлено тем, что NH3 создает большее кристаллическое поле, чем вода (разд. 5 гл. II). Аналогично установлено, что некоторые переходные элементы образуют очень устойчивые комплексы с такими лигандами, как СО, CN-, C2H4 и Р(СН3)3, в то время как с непереходными элементами эти лиганды образуют малоустойчивые комплексы. Устойчивость комплексов с переходными металлами можно связать со стабилизацией кристаллическим полем, вызываемым этими лигандами. Ковалентная связь металл - лиганд становится исключительно важной в комплексах сравнительно электроотрицательных металлов, таких, как металлы подгрупп меди и цинка, а также олова и свинца. Для этих металлов электростатическое объяснение устойчивости не дает хороших результатов. Например, серебро образует нерастворимые галогениды, AgX, и устойчивые галогенидные комплексы, AgX2- и AgX32-, располагающиеся по устойчивости в порядке I->Br->Cl->>F-. Константы устойчивости в соответствии с уравнением (17) имеют следующие значения:
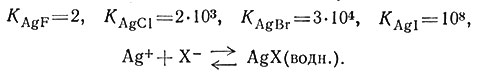
(17)
Это поведение приписывают ковалентности связи Ag - X, усиливающейся при переходе от F- к I-.
Ртуть, свинец, висмут, переходные и следующие за переходными металлы образуют нерастворимые в воде сульфиды. Осаждение сульфидов является частью традиционного метода анализа при качественном .определении металлов. Образование осадка можно рассматривать как образование незаряженного, нерастворимого в воде комплекса; осаждение сульфидов указывает на то, что эти металлы предпочитают серусодержащие лиганды кислородсодержащим (в данном случае предпочитают S2- по сравнению с O2-). Это предпочтение можно отнести за счет ковалентного характера связи металл - сера.
Металлы класса б характеризуются наличием у атомов некоторого числа d-электронов вне электронных оболочек атомов инертного газа. Эти d-электроны могут образовать с атомами лиганда π-связь, и наличие такой я-связи обусловливает многие свойства комплексов металлов класса б. Наиболее устойчивые комплексы эти металлы образуют с теми лигандами, которые могут принимать электроны от металла, т. е. с лигандами, имеющими свободные d-орбиты, такие, как Р(СН3)3, S2- и I-, или с лигандами, у которых электроны, находящиеся на молекулярных орбитах, могут быть делокализованы; к числу таких лигандов относятся СО и CN- (рис. 21). Таким образом установлено, что элементы классов а и б образуют устойчивые комплексы с различными типами лигандов. Элементы класса а предпочитают кислород- и азотсодержащие лиганды, а также F-. Элементы класса б образуют более устойчивые комплексы с тяжелыми элементами подгрупп азота, кислорода и фтора*.
* (Профессор Пирсон [J. Am. Chem. Soc, 85, 3533 (1963)] назвал металлы класса а жесткими кислотами, а металлы класса б мягкими кислотами. Атомы лиганда, такие, как N, О, и F, он отнес к жестким основаниям, а атомы лиганда, подобные Р, S и I,- к мягким основаниям. Самые устойчивые комплексы получаются при комбинациях жесткой кислоты с жестким основанием и мягкой кислоты с мягким основанием.)
Трудно дать всеобъемлющее объяснение устойчивости комплексов, поскольку теплота, выделившаяся по реакции (18), очень незначительна.
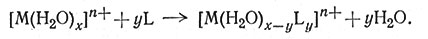
(18)
Множество сравнительно небольших эффектов, таких, как образование π-связи, стабилизация кристаллическим полем, усиление ковалентности связи металл - лиганд, может обусловить такое количество энергии, которое достаточно, чтобы изменить процесс, который мы называем "нормальным".
Изменение энтропии имеет также большое значение в устойчивости комплекса. Реакция, в которой положительный ион, взаимодействуя с отрицательными лигандами, образует комплекс с более низким зарядом (19), протекает со значительным увеличением энтропии;это является основным фактором устойчивости получающегося комплекса.
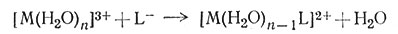
(19)
Большое изменение энтропии возникает главным образом оттого, что каждый заряженный реактант имеет упорядоченную сольватную оболочку. Продукты реакции, имеющие более низкий заряд, сольватированы значительно меньше. Надо отметить, что факторы, увеличивающие энтропию, те же, что и повышающие устойчивость комплексов с электростатической точки зрения. Следовательно, электростатическое предсказание высокой устойчивости комплексов, образуемых небольшими и высокозаряженными ионами, может быть правильным в значительной степени за счет энтропийного эффекта.
Рассмотрение энтропии очень важно в двух других отношениях. При образовании комплекса [ML6]n+ из [М(Н2O)6]n+ замена каждой последующей молекулы Н2O лигандом L все больше затрудняется. Например, ступенчатые константы устойчивости реакции (20) равны: K1 = 5*102, K2 = 1,3*102, K3 = 4*101, K4 = 1,2*101, K5 = 4 и K6 = 0,8.
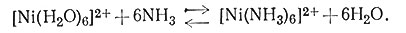
(20)
Этот эффект возникает по крайней мере частично вследствие статистического характера процессов замещения (рассмотрение энтропии). Замещение одной молекулы воды молекулой аммиака уменьшает на единицу число возможных координационных мест для следующих молекул аммиака. Кроме того, чем больше молекул аммиака в комплексе, тем больше вероятность замены их молекулами воды. Оба эти фактора уменьшают вероятность образования, а следовательно, и устойчивость более высокозамещенных комплексов. Другие факторы, такие, как стерическое отталкивание между большими по объему лигандами и электростатическое взаимное отталкивание лигандов - анионов при их замещении молекул воды у положительно заряженного иона металла, также могут задерживать координирование дополнительных лигандов.
Однако есть несколько примеров, в которых начальный комплекс менее устойчив, чем более высокозамещенный. Отклонение от регулярного уменьшения последовательных констант устойчивости в некоторых случаях можно объяснить изменением координационного числа иона металла. Константы устойчивости
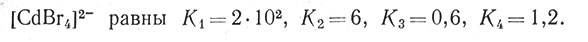
Координационное число кадмия в гидратировапном ионе

(21)
и в [CdBr4]2-, вероятно, равно соответственно 6 и 4; большая величина K4 по сравнению с K3 может указывать на то, что реакция (21), соответствующая этой константе, включает как изменение координационного числа, так и присоединение Br-. Поскольку в реакции освобождаются три молекулы воды, конечная ступень комплексообразования сопровождается значительным увеличением энтропии, а следовательно, и повышением K4.
Вторым, очень важным энтропийным эффектом является большая устойчивость металлических хелатов (см. определение хелата в разд. 3 гл. I). Аммиак и этилендиамин (en) координируются ионом металла через аминный азот; с точки зрения количества теплоты, выделяющейся в реакциях комплексообразования, две молекулы NH3 эквивалентны одной молекуле en. Однако комплексы этилендиамина значительно устойчивее, чем аналогичные комплексы аммиака (например, [Ni(NH3)6]2+, K1K2 = 6*104; K3K4 = 5*102, K5K6 = 3. [Ni(en)3]2+, K1 = 2*101; K2 = 1,2*106; K3 = 1,6*104). Экспериментально было показано, что большая устойчивость соединений этилендиамина обусловливается большим возрастанием энтропии, связанным с их образованием.
Вообще хелатообразующие агенты дают более устойчивые комплексы, чем их монодентатные аналоги. Этот факт известен как хелатный эффект, и его объясняют при помощи благоприятного энтропийного эффекта для образования хелата. Качественно это понятно. Замена координированной молекулы воды молекулой NH3 или en равновероятна. Однако замена второй молекулы воды другой аминной группой уже координированной молекулы этилендиамина более вероятна, чем замена ее свободной молекулой аммиака из раствора, так как молекула en уже связана с ионом металла и свободный ее конец находится в непосредственной близости от молекулы H2O, которую он заменяет. Так, образование [Ni(en)(H2O)4]2+ более вероятно, чем образование менее устойчивого Ni(NH3)2(H2O)4]2+.
Другой вариант наглядного представления более благоприятного энтропийного эффекта основан на том, что процесс, в котором увеличивается число независимых частиц, протекает с увеличением энтропии (большее число частиц влечет за собой больший возможный беспорядок). При координировании одной молекулы en освобождаются две молекулы H2O; этот процесс будет протекать с благоприятным энтропийным эффектом.
Три-, тетра- и другие полидентантные лиганды могут заменять три, четыре и большее число координированных молекул воды соответственно с образованием более устойчивых комплексов. Константы устойчивости для некоторых комплексов никеля(II) с полидентатными лигандами приведены в табл. 12. Этилендиаминтетраацетат (EDTA) гексадентатный лиганд (см. XXVII в разд. 4 гл. III) образует устойчивые комплексы с большим числом ионов металлов, включая щелочноземельные металлы (которые образуют очень нестойкие комплексы с монодентатными лигандами). Это соединение было использовано в технике под названием секвестрен как реагент, образующий комплексы с ионами металлов и таким образом осуществляющий контроль их концентрации в растворе. Например, EDTA дает устойчивые комплексы с ионом кальция и поэтому является прекрасным умягчителем воды. Это соединение используют так же, как аналитический реагент.

Таблица 12. Влияние образования хелата на устойчивость комплексов а
a (Все значения β измерены в 1 М растворе KCl при 300. Чтобы заметить эффект, нужно сравнить величины β, которые подчеркнуты одинаковой линией.)
б (dien = H2N"CH2CH2N"HCH2CH2N"H2.)
в (trien = H2N"CH2CH2N"HCH2CH2N"HCH2N"H2.)
В щелочном растворе EDTA количественно реагирует с ионами некоторых металлов, образуя комплексы (22). Поэтому его можно применять для объемного определения многих металлов.
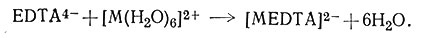
(22)
Для определения конечной точки титрования предложено несколько очень эффективных индикаторов; такое объемное определение теперь обычно используют в химическом анализе.
Хелаты металлов содержат циклы атомов (см. II). Было установлено, что устойчивость комплексного иона зависит от числа атомов в цикле. Было обнаружено, что для лигандов, не имеющих двойных связей, наиболее устойчивые комплексы образуются, когда число атомов в цикле равно пяти. Лиганды с двойными связями, такие, как ацетил-ацетон, образуют очень устойчивые комплексы с шести-членными циклами. Найдено, что хелатные циклы могут состоять из четырех или более чем из шести атомов, но они относительно нестойки и редко встречаются.
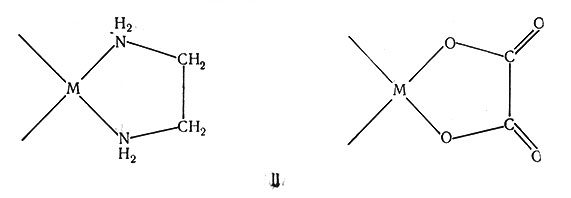
В настоящее время имеется множество сведений об устойчивости комплексов. Оно позволяет оценить факторы, влияющие на устойчивость комплексов металлов. Некоторые из этих факторов были уже рассмотрены в данной главе, и, возможно, полезно их кратко суммировать. Во-первых, устойчивость комплекса, очевидно, зависит от природы металла и лиганда. В отношении иона металла важными являются следующие факторы:
- Размер и заряд. Вследствие значительного влияния электростатических сил в этих системах меньший по величине и больший по заряду ион металла образует более прочный комплекс. Таким образом, большое отношение заряда к радиусу иона металла обусловливает образование устойчивого комплекса.
- Эффект кристаллического поля. Энергия стабилизации кристаллическим полем имеет большое значение в устойчивости комплексов переходных металлов, и, оказывается, она обусловливает естественный порядок устойчивости комплексов первого ряда переходных металлов (рис. 31).
- Металлы классов а и б. Более электроположительные металлы, например Na, Ca, Al, лантаниды, Ti и Fe, относятся к классу а. Менее электроположительные металлы, например Pt, Pd, Hg, Pb и Rh, принадлежат к классу б. Металлы класса а образуют наиболее устойчивые комплексы с лигандами, у которых донорными атомами являются элементы подгрупп N, О или F; металлы класса б предпочтительно соединяются с лигандами, в которых донорными атомами являются более тяжелые элементы подгрупп N, О или F. Предполагают, что устойчивость комплексов металлов класса б является следствием значительной доли ковалентности связей металл - лиганд и переноса электронной плотности от металла к лиганду посредством π-связи.
Изучая роль лиганда в устойчивости комплексов, важно иметь в виду следующие факторы:
- Сила основности. Большая основность лиганда вызывает большую устойчивость комплексов, образуемых лигандами с металлами класса а.
- Хелатный эффект. Устойчивость хелата больше, чем, его нехелатного аналога, например [Ni(en)3]2+>[Ni(NH3)6]2+. Более характерное хелатообразование приводит к более устойчивым системам; например, очень устойчивы комплексы гексадентантного лиганда EDTA.
- Размер хелатного цикла. Наиболее устойчивые хелатные комплексы образуются для лигандов с насыщенными связями в случае пятичленных циклов, а для лигандов с ненасыщенными связями - в случае шестичленных циклов.
- Стерическое напряжение. Вследствие стерических факторов объемные лиганды образуют менее устойчивые комплексы с металлами, чем аналогичные, но меньшие по объему лиганды; например, H2NCH2CH2NH2 образует более устойчивые комплексы, чем (CH3)2NCH2CH2N(CH3)2. Напряжение иногда обусловлено геометрией лиганда в сочетании со стереохимией комплекса. Например, молекула H2NCH2CH2NHCH2CH2NHCH2CH2NH2 может координироваться четырьмя атомами азота по углам квадрата, a N(CH2CH2NH2)3 не может; поэтому неразветвленная цепь тетраамина образует более устойчивые комплексы с Cu2+, чем амин с разветвленной цепью, который не может уложиться в плоский квадрат.
Величины заряда, размер, стабилизация кристаллическим полем и их влияние на устойчивость комплексов металлов существенно важны для химии координационных соединений. Например, окислительный потенциал ионов металлов заметно изменяется при изменении типа лиганда (табл. 13). При замене молекул H2O в комплексах Fe2+ и Co2+ лигандами CN-, EDTA или NH3 тенденция к окислению этих ионов до состояния M3+ заметно возрастает. Перечисленные лиганды образуют с ионами M3+ значительно более прочные комплексы, чем с ионами M2+, что и способствует окислению. В частности, это справедливо для Co2+-систем. Комплекс [Со(H2O)6]3+ будет окислять воду до O2; наоборот, водные растворы солей Co2+ легко окисляются кислородом воздуха в комплексы [Co(III)L6] в присутствии лигандов, таких, как NH3, CN- или NO2-. Значительное изменение окислительного потенциала из-за присутствия этих лигандов вызвано тем, что они создают большее кристаллическое поле, чем вода; это способствует превращению высокоспиновых d7-комплексов Co2+ в низкоспиновые d6-комплексы Co3+ с высокой стабилизацией кристаллическим полем.

Таблица 13. Окислительные потенциалы некоторых комплексов кобальта и железа
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'