
3. Определение констант устойчивости
Выводы, которые были сделаны относительно устойчивости комплексов, следуют из сопоставления значений констант их устойчивости. Экспериментальное определение констант устойчивости - важная, но часто трудная задача. Вероятно, самая большая трудность заключается в установлении вида частиц, действительно находящихся в растворе при равновесии. Многие ранние исследования были опровергнуты более поздними работами, установившими, какие вещества и равновесия не были учтены. Константы равновесия определяли множеством различных методов. Обычно готовят раствор, содержащий ион металла и лиганд, и через некоторое время, достаточное для приведения системы в равновесие, измеряют концентрацию веществ в растворе.
Из выражения константы равновесия (23) ясно, что ее можно вычислить, если измерить равновесные концентрации А, В и С.
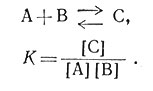
(23)
Действительно, в простой системе (23), если известны количества А и В до начала реакции и затем измерена равновесная концентрация А, В или С, то можно установить концентрации двух других веществ и вычислить константу равновесия. Во всех системах, содержащих комплексы, при равновесии существует большое число видов комплексов. В этих случаях необходимо экспериментально измерять концентрацию более одного вида частиц. Соответствующие вычисления иногда утомительны, но обычно просты. Для более сложных систем с успехом применяют счетные машины.
Измерение равновесных концентраций веществ осложняется тем, что это определение не должно нарушать равновесия. Например, в случае реакции (24) концентрацию ионов Cl- в растворе нельзя измерить осаждением в виде AgCl.
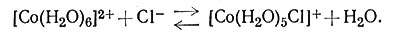
(24)
Добавление иона Ag+ приведет к осаждению не только свободного хлорид-иона, но и удалит Cl- из комплекса.
Вторая трудность возникает оттого, что константы равновесия должны быть выражены через активности, а не через концентрации. Поскольку активность и концентрация в очень разбавленных растворах численно равны, то можно избежать этой трудности, поддерживая концентрации всех веществ низкими. Практически это редко можно осуществить. Другой способ обойти эту трудность заключается в определении констант устойчивости серии растворов, каждый из которых содержит различные количества "некомплексообразующей" соли типа NaClO4. В этом случае среда в растворе отклоняется от "идеальности", главным образом за счет ионов Na+ и ClO-4, и неравенство коэффициентов активности единице большей частью обусловливается этими ионами. Экстраполяцией концентрации соли к нулю находят константу устойчивости в среде с коэффициентом активности, равным единице.
Часто результаты исследования равновесия получают для относительно концентрированных растворов и не делают попыток по величинам концентрации найти активности. Константы равновесия, вычисленные с использованием концентраций, а не активностей, называют концентрационными константами; они количественно точны только для тех условий, при которых их определяли. Однако в большинстве случаев сравнение концентрационных констант, полученных в одинаковых экспериментальных условиях, дает надежную информацию об относительной устойчивости аналогичных систем. Это важно для понимания того факта, что истинную константу устойчивости можно использовать в случае количественного вычисления концентраций только для очень разбавленных растворов или для растворов с известными коэффициентами активности. Концентрационные константы можно использовать при вычислении концентраций веществ в растворе, но последние будут количественно верными только для тех условий, в которых была определена константа. Поэтому чаще всего эти константы используют при полуколичественном исследовании.
Концентрацию веществ в растворе можно измерять многими методами, которые не нарушают равновесия при исследовании. Самыми распространенными являются спектро-фотометрические и электрометрические методы. Первые основаны на поглощении света изучаемыми веществами, вторые - на электрохимических свойствах исследуемых систем. Применение спектрофотометрического метода можно продемонстрировать на примере изучения равновесия Fe3+-NCS- (25).
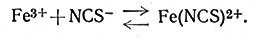
(25)
Ион Fe3+ и тиоцианат-ион, взятые порознь, в растворе почти бесцветны, а комплекс FeNCS2+ окрашен в яркий красно-оранжевый цвет; это значит, что индивидуальные ионы не поглощают видимый свет, а комплекс FeNCS2+ поглощает. Интенсивность окраски непосредственно зависит от концентрации FeNCS2+ и может быть использована для измерения концентрации этих ионов в растворе. Если к раствору добавить известные количества Fe3+ и NCS- и затем определить количество FeNCS2+, измерив интенсивность окраски раствора, то можно вычислить [Fe3+] и [NCS-]:
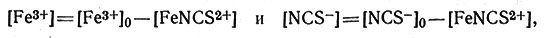
где [Fe3+]0 и [NCS-]0 - первоначальные значения концентраций Fe3+ и NCS-. Константу равновесия можно вычислить по уравнению (26). Следует отметить, что измерения в действительности значительно сложнее, чем может показаться, судя по описанию, так как в растворе присутствует и комплекс типа [Fe(NCS)2]+. Можно поставить эксперимент в присутствии избытка Fe3+ и пренебречь концентрацией более высоких комплексов, считая, что в растворе в основном будут находиться только Fe3+ и FeNCS2+.
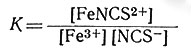
(26)
Самым простым электроаналитическим способом определения константы устойчивости является метод с применением стеклянного электрода. Этот прибор - основная составная часть обычного лабораторного рН-метра, используемого для определения активности ионов Н+ в растворе; поэтому со стеклянным электродом изучают только равновесия, включающие изменение [Н+]. Я. Бьеррум - профессор Копенгагенского университета,- еще будучи студентом, определил этим методом константы устойчивости большого числа амминных комплексов. Концентрация NH3 в растворе связана с [Н+] константой равновесия кислотной диссоциации NH4+ (27).
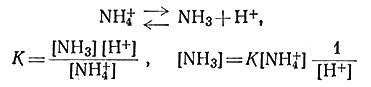
(27)
В кислом растворе величина [NH4]+ велика по сравнению с [NH3]; таким образом, [NH4] практически не изменяется при увеличении [Н+]. В кислых растворах
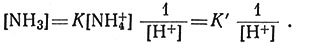
Отсюда следует, что при соответствующих условиях, измеряя [Н+] стеклянным электродом, можно прямо измерить [NH3]. Этим методом были определены константы устойчивости системы Ag+ - NH3 [(28), (29)].
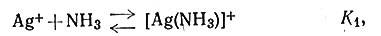
(28)
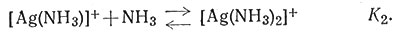
(29)
Опыты проводили при 30,0°; растворы готовили с различными небольшими концентрациями NH3 и Ag+. Измеряли величину рН каждого раствора и вычисляли по уравнению (27) концентрацию свободного NH3. Некоторые данные приведены в табл. 14.
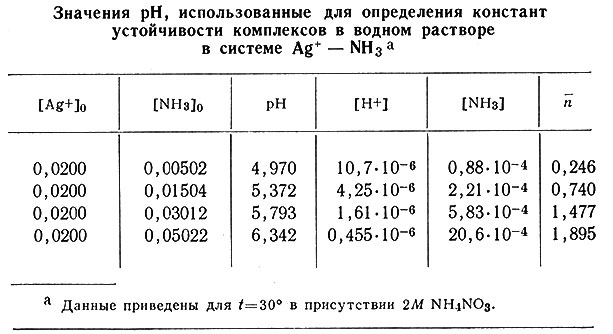
Таблица 14. Значения рН, использованные для определения констант устойчивости комплексов в водном растворе в системе Ag+ - NH3a
а (Данные приведены для t = 30° в присутствии 2М NH4NO3.)
При помощи уравнения (30) по экспериментальным данным можно определить среднее число молекул аммиака (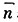 ), связанных с Ag+.
), связанных с Ag+.
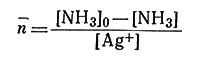
(30)
График зависимости 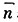 от концентрации свободного NH3 показан на рис. 32. На основании данных этого рисунка можно заключить, что при концентрации свободного аммиака выше 10-2 М преобладающим комплексом является [Ag(NH3)2]+, в то время как при концентрации свободного аммиака ниже 10-4 М в растворе преобладает ион серебра. Комплекс [Ag(NH3)]+ присутствует только в очень узком интервале концентраций NH
от концентрации свободного NH3 показан на рис. 32. На основании данных этого рисунка можно заключить, что при концентрации свободного аммиака выше 10-2 М преобладающим комплексом является [Ag(NH3)2]+, в то время как при концентрации свободного аммиака ниже 10-4 М в растворе преобладает ион серебра. Комплекс [Ag(NH3)]+ присутствует только в очень узком интервале концентраций NH
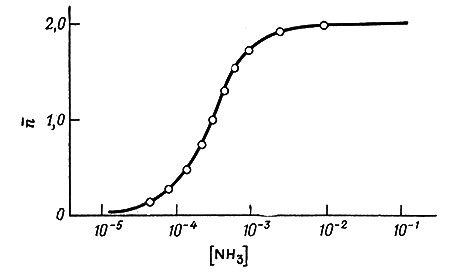
Рис. 32. Среднее число молекул NH3, связанных с одним ионом Ag+, в зависимости от концентрации свободного аммиака в растворе. Данные приведены для 30° и 2,0М раствора NH4NO3
Выше были кратко описаны два метода определения констант устойчивости. Для этих целей пригодны и многие другие приемы. Например, довольно распространены методы с применением радиоактивных изотопов и использование жидкостной экстракции (жидкость - жидкость) или ионного обмена. Практически любой метод измерения концентрации можно применить для определения констант устойчивости.
Устойчивость комплексов в растворе - один из важных аспектов химии металлов в растворах. Вопросы, связанные со структурой растворителя, строением и природой гидратной оболочки растворенных частиц, реакциями между растворенными частицами в растворе и устанавливающимся затем равновесием, давно уже интересовали химиков. Собрано множество экспериментальных данных и тщательно разработаны теории для объяснения их. И несмотря на эти усилия, исследования химии растворов далеко не закончены. Пока еще нет подробных сведений о числе молекул воды, окружающих большинство ионов в водном растворе, нет и надежных значений констант устойчивости для многих соединений, особенно малопрочных или, наоборот, очень прочных комплексов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'