
VI. Кинетика и механизм реакций координационных соединений
Вероятно, самое важное применение комплексы металлов имеют в каталитических реакциях. Изучение ферментов (физиологических катализаторов) показывает, что часть реакций в биологических системах включает комплексообразование с ионом металла. Некоторые процессы в промышленности катализируются комплексами металлов. В гл. I было упомянуто, что в производстве полиэтилена в качестве катализаторов используют комплексы алюминия и титана. Реакция олефинов с окисью углерода и водородом протекает в присутствии комплекса кобальта (1).
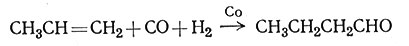
(1)
Последняя очень важная реакция - оксосинтез - была подробно изучена; известно, что катализатором является HCo(CO)4, который регенерируется в процессе самой реакции. Окисление воздухом этилена до ацетальдегида легко протекает в присутствии системы катализаторов PdCl2 - CuCl2 (2).
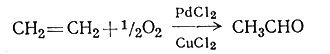
(2)
Этот промышленный процесс зависит от образования промежуточного комплекса [Pd(C2H4)(OH)Cl2]-. Эти и многие другие новые области применения комплексов металлов вызывают интерес химиков-исследователей и увеличивают производительность и разносторонность химической промышленности. Чтобы использовать комплексы металлов, необходимо изучить реакционные процессы более детально. В этой главе проиллюстрирован подход к таким вопросам, приведены примеры достижений в этой области, а также предложены некоторые теории реакций.
В предыдущих главах было рассмотрено большое число реакций координационных соединений. В некоторых случаях координационные соединения получались из более простых веществ, другие реакции иллюстрировали превращение одних координационных соединений в другие. В гл. V было показано, что константы равновесия этих реакций зависят от количества выделившейся теплоты и степени возникшего беспорядка (энтропии). Выделение теплоты и благоприятное изменение энтропии - необходимые условия течения реакций. Однако скорость реакции должна быть достаточно большой, чтобы реакция осуществилась. Реакции могут идти с различной скоростью; некоторые идут неизмеримо медленно, другие - настолько быстро, что только недавно удалось измерить их скорость.
Некоторые реакции, например экзотермическое взаимодействие H2 и O2 с образованием H2O, не идут, пока не будет подожжена реакционная смесь. Другие, менее экзотермические реакции, например эндотермическое растворение солей в воде, проходят быстро при комнатной температуре. Это указывает на то, что скорость реакции не обязательно зависит от количества выделившейся теплоты. Реакции со значительно смещенным состоянием равновесия в сторону продуктов реакции не всегда характеризуются большой скоростью. Скорость химической реакции зависит от пути, по которому осуществляется превращение исходных веществ в конечные продукты (механизма реакции). Знание механизма реакции часто позволяет понять ее режим. Практически более важно именно то, что путем изучения скорости реакции можно получить много сведений о механизме реакции.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'