
1. Скорость реакции
Скорость реакции типа (3) можно представить как функцию уменьшения числа молей исходных веществ [Co(NH3)5Cl]2+ и H2O в секунду (или в какую-либо другую единицу времени) или увеличения числа молей продуктов реакции [Co(NH3)5H2O]3+ или Cl- в секунду. Поскольку вступление в реакцию 1 моля [Co(NH3)5Cl]2+ вызывает появление 1 моля [Co(NH3)5H2O]3+ и 1 моля Cl-, эти три способа выражения скорости приводят к одному и тому же численному результату. Вообще скорость какой-либо реакции можно определить как изменение концентрации одного из исходных веществ или продуктов реакции в единицу времени.
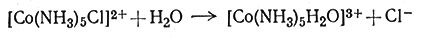
(3)
Удобным способом количественного выражения скорости реакции является понятие о периоде полупревращения.
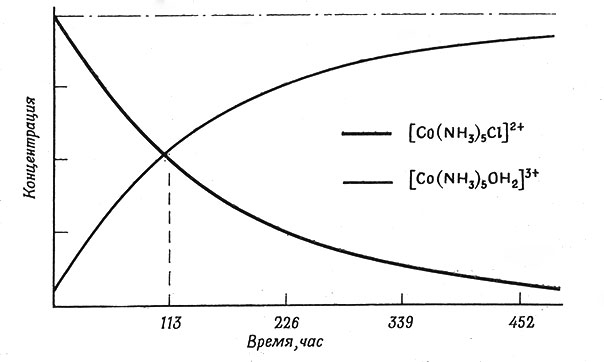
Рис. 33. Зависимость концентраций исходных и конечных комплексов для реакции (3) от времени при 25°
Периодом полупревращения реакции считают промежуток времени, в течение которого расходуется половина исходного вещества или образуется половина конечного продукта. Найдено, что период полупревращения реакции (3) при 25° равен 113 час. Это значит, что если растворить в воде при 25° соль, содержащую ионы [Go(NH3)5Cl]2+, то через ИЗ час в растворе останется только половина [Co(NH3)5Cl]2+, половина же превратится в [Co(NH3)5H2O]3+ и Cl- (рис. 33). После следующих 113 час прореагирует еще половина оставшегося [Co(NH3)5Cl]2+, и в растворе останется только четверть первоначально взятого количества и т. д. Несмотря на то что вода участвует в этой реакции, ее количество в первые 113 час не уменьшается вдвое, поскольку как растворитель она находится в большом избытке. Концентрации же [Co(NH3)5H2O]3+ и Cl- будут равны половинам тех величин, которые они имели бы, если бы реакция прошла полностью.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'