
2. Уравнения для скорости реакций
Определив понятие скорости реакции, посмотрим, что можно о ней узнать из рассмотрения механизма реакции. Простейший тип реакций, которые можно себе представить,- это реакция изомеризации (4) и диссоциации (5).

(4)
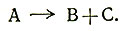
(5)
Реакции этого типа могут идти более сложным путем через образование промежуточных соединений; однако сначала рассмотрим самый простой механизм, по которому А непосредственно переходит в А' (или в В + С). В этом случае следует ожидать, что скорость реакции будет зависеть только от концентрации А. Чем больше молекул А присутствует, тем больше вероятность того, что одна молекула вступит в реакцию. Таким образом, скорость реакции прямо пропорциональна концентрации А (6). Это можно записать, используя постоянную k, которая называется константой скорости и является числом, характеризующим
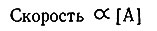
(6)
скорость реакции при данной температуре (7). Для быстро идущих реакций k - большая величина; для медленных
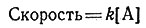
(7)
реакций k очень мала. Существует большое число реакций, для которых применимо такое простое выражение скорости реакции, например, превращение в метанольном растворе цис-[Co(en)2Cl2]+ в транс-[Co(en)2Cl2]+ (8).
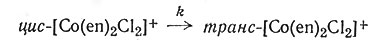
(8)
Скорость превращения цис-изомера в транс-изомер равна произведению константы скорости реакции на концентрацию цис-изомера (9).
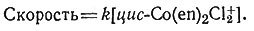
(9)
Реакция может идти и более сложным путем (10). При таком механизме А превращается в А' через промежуточное соединение Е (10а), которое затем переходит в А' (10б). Образование Е должно явиться следствием соударения
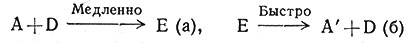
(10)
молекул А и D. Скорость этого процесса будет пропорциональна концентрации А и D (11), так как вероятность соударения их молекул непосредственно зависит от их
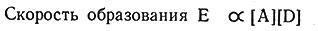
(11)
концентрации. В многоступенчатом процессе общая скорость реакции определяется скоростью самой медленной ступени реакции, которая называется скорость определяющей ступенью. Если диссоциация Е происходит значительно быстрее, чем его образование, А' и Е будут получаться одинаково быстро, и, следовательно, скорость образования А' будет равна скорости образования Е. Переписав выражение для Е, найдем скорость образования А' (12).
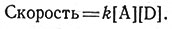
(12)
Вещество D не расходуется в реакции, но скорость реакции зависит от его концентрации; это вещество называют катализатором. Внутримолекулярное превращение (13) оптических изомеров [Co(en)3]3+ катализируется [Co(en)3]2+, и выражение скорости этой реакции имеет вид, представленный уравнением (14). Известно, что скорость определяющей ступенью в реакции (13) является перенос электрона от [Co(en)3]2+ к [Co(en)3]3+ (разд. 8 гл. VI).
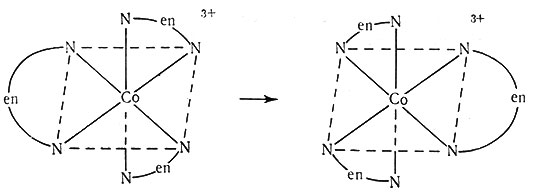
(13)
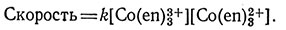
(14)
Третий, но самый маловероятный механизм реакции показан уравнениями (15) и (16). Он заключается в медленном образовании промежуточного соединения Е путем
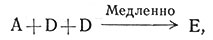
(15)
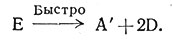
(16)
соударения молекулы А с двумя молекулами D (15). Скорость образования Е и А', если Е разлагается и образуется с одинаковой быстротой, дана выражением (17). Соударение трех частиц очень маловероятно; следовательно, такие реакции очень медленны и крайне редки.
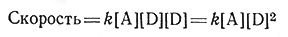
(17)
Выражение для скорости реакции, написанное для трех различных способов превращения А в А', называют уравнением скорости реакции. Оно описывает влияние концентрации на скорость реакции. Уравнение скорости реакции первого порядка имеет вид (7); говорят, что скорость реакции (или просто реакция) подчиняется уравнению первого порядка относительно А или просто является реакцией первого порядка относительно [А]. О реакциях, подчиняющихся уравнению скорости второго порядка (12), говорят, что они являются реакциями первого порядка относительно [А] и относительно [D]. Уравнение скорости третьего порядка (17) указывает, что реакция, протекающая по этому закону, является реакцией первого порядка по отношению к [А] и второго порядка по отношению к [D].
Порядок реакции зависит от числа видов частиц и от степени, в которой концентрация каждого вида частиц входит в уравнение скорости. Часто порядок реакции равен числу соударяющихся частиц в скорость определяющей ступени реакции. В дальнейшем будет приведено несколько примеров, в которых порядок реакции меньше числа частиц, участвующих в скорость определяющей ступени реакции. Из всего сказанного выше ясно, что уравнение скорости реакции нельзя написать на основании лишь стехиометрического уравнения реакции. Так, уравнение скорости реакции А → А' может содержать концентрации таких видов частиц, которые не входят в уравнение химической реакции; также не всегда обязательно включать в него концентрацию А или А'. Если экспериментально установить уравнение скорости реакции, то можно узнать, какие частицы участвуют в скорость определяющей ступени реакции, а следовательно, получить необходимые сведения о механизме реакции.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'