
3. Эффективные соударения
Если можно предсказать константы скорости, то можно определить, какие реакции протекают быстро, а какие практически не идут. Для теоретического рассмотрения констант скорости следует прибегнуть к теории соударений. Скорость реакции дана уравнением скорости, которое состоит из константы скорости и концентрации веществ, участвующих в самой медленной ступени реакции. Зависимость скорости реакции от концентрации в уравнении скорости связана с вероятностью соударения между молекулами реагирующих веществ. Если каждое соударение приводило бы к реакции, константа скорости не имела бы принципиального значения. В действительности же в большинстве реакций многие соударения не эффективны; таким образом, константа скорости является мерой эффективности соударения, и ее величина зависит главным образом от пространственной ориентации и энергии молекул при соударении.
Чтобы осуществилась реакция, должна быть подходящей геометрия соударения. Так, для осуществления реакции между молекулами или ионами, имеющими несферическую форму, частицы при соударении должны быть определенным образом ориентированы в пространстве. Например, цианид-ион для образования связи металл - углерод должен приблизиться к иону металла той стороной, где находится атом углерода (18)
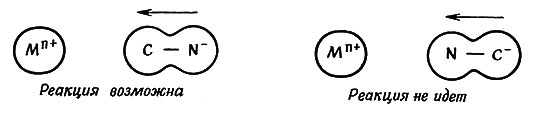
(18)
Геометрия реакции - важный фактор для реакций в газовой фазе, но она не менее важна и в растворе. Молекулы в растворе находятся в окружении молекул растворителя, и, следовательно, они обычно много раз соударяются с ними, прежде чем продвинутся в другое место. Таким образом, до того как ион CN- подойдет к иону металла, он много раз столкнется с молекулами воды, прежде чем выйдет из их окружения; почти наверное, некоторые из этих соударений приведут к ориентации, необходимой для реакции.
Самым важным фактором, определяющим скорость большинства реакций, является энергия соударения. В реакции аммиака с водным раствором Ag+ молекулы NH3 должны занять место координированных молекул воды. Соударение должно обусловить необходимую для этого процесса энергию; в противном случае реакция идти не будет. Если молекулы использовали энергию, полученную ими при соударении, и пришли в такое состояние, что реакция будет идти без дальнейшего добавления энергии, то говорят, что образовался активный комплекс. Количество энергии, необходимое для образования активного комплекса, называют энергией активации (рис. 34). В реакциях с малой энергией активации большинство столкновений в энергетическом отношении будут достаточны для течения реакции. Очень высокая энергия активации приводит к тому, что большинство столкновений не эффективны. Величина константы скорости реакции вообще тем больше, чем меньше величина энергии активации. Механизм реакции определяет конфигурацию и энергию активного комплекса, а следовательно, и энергию активации и скорость реакций.
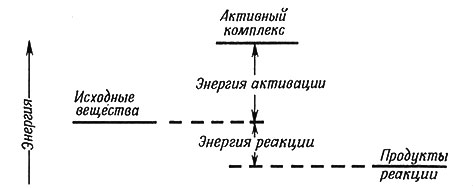
Рис. 34. Относительные энергии исходных веществ, активного комплекса и продуктов реакции
Реакции, характеризующиеся высокими энергиями активации, можно ускорить повышением температуры или использованием катализатора. Повышение температуры увеличивает скорость реагирующих частиц и, следовательно, интенсивность их соударений. С другой стороны, катализатор так изменяет механизм реакции, что новый активный комплекс, в котором находится катализатор, образуется при более низких энергиях соударений.
Реакция может идти также и по механизму, не предусматривающему соударения. В таких реакциях пространственная ориентация молекул при соударениях, конечно, не влияет на скорость реакции. Однако простые реакции этого типа характеризуются определенной энергией активации. Для приобретения конфигурации активного комплекса реагирующая молекула должна накопить энергию за счет соударений с соседними молекулами (молекулами растворителя) или за счет поглощения лучистой энергии, и только тогда реакция может идти. Константа скорости этого типа процессов будет мерой того, насколько часто молекулы будут накапливать достаточную для реакции энергию.
Для всех реакций можно предположить множество механизмов; тот, который найден, является обеспечивающим в условиях эксперимента самую быструю реакцию. Процессы, идущие более медленно, дают небольшой или ничтожный вклад в общую реакцию.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'