
4. Инертные и лабильные комплексы
Комплексы, в которых лиганды быстро замещаются на другие, называются лабильными комплексами, те, у которых такое замещение проходит медленно, называются инертными. Чтобы установить количественное различие, Генри Таубе, профессор Университета в Станфорде, предложил комплексы, в которых замещение лигандов протекает менее чем за одну минуту, называть лабильными. Условия реакции: температура 25° и концентрация 0,1 М исходных реагентов. Несмотря на то что часто устойчивые комплексы инертны, а неустойчивые лабильны, все же это не всегда выполняется. Ион цианида образует с Ni2+ и Hg2+ очень устойчивые комплексы. Устойчивость их следует из того, что равновесие (19) сдвинуто далеко вправо и что ион Ni2+ предпочитает в качестве лигандов ионы CN-, а не молекулы H2O.
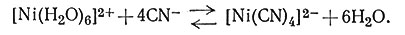
(19)
Однако если в раствор добавить цианид-ион, меченный 14С, то он почти мгновенно перейдет в комплекс* (20). Таким образом, устойчивость этого комплекса не обеспечивает его инертности.
* (Меченый ион 14CN- действительно химически идентичен немеченому CN-; поэтому реакция протекает до тех пор, пока отношение 14CN-/CN- в комплексе и в растворе не будет одинаковым.)
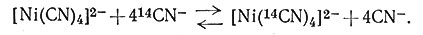
(20)
Гексаамминкобальт(III) [Co(NH3)6]3+ не устойчив в кислом растворе - происходит почти полное его превращение в [Co(H2O)6]2+, NH4+ и O2 (21). Однако [Co(NH3)6]3+ может существовать при комнатной температуре в кислом растворе без заметного разрушения несколько суток.
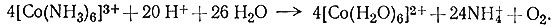
(21)
Скорость превращения очень мала; и, следовательно, соединение неустойчиво в кислом растворе, но вместе с тем инертно.
Глава V посвящена вопросам устойчивости координационных соединений; в этой главе рассмотрена скорость реакции или лабильность. Важно помнить, что эти термины относятся к разным явлениям. Устойчивость комплекса зависит от различия энергий исходных веществ и продуктов реакции (энергия реакции на рис. 33). Устойчивое соединение будет характеризоваться значительно меньшей энергией, чем возможные продукты реакции. Лабильность соединения зависит от различия энергий соединения и его активного комплекса; если величина энергии активации большая, то реакция будет идти медленно.
Для комплексов с координационным числом шесть можно предсказать с определенной степенью надежности, какие комплексы будут лабильны, а какие инертны. Таубе первый обратил на это внимание, указав, что электронная структура комплекса оказывает существенное влияние на скорость реакций, в которые он вступает. Классификация шестикоординационных комплексов по числу и типу d-электронов центрального атома следующая:
Лабильные комплексы
- Все комплексы, в которых центральный атом металла содержит d-электроны на eg-орбитах (dx2-y2- и dz2-орбиты, направленные к шести лигандам; см. разд. 5 гл. II), например [Ga(C2O4)3]3-, d10(t62ge4g); [Co(NH3)6]2+, d7(t52ge2g); [Cu(H2O)6]2+, d9(t62ge3g); [Ni(H2O)6]2+, d8(t62ge2g); [Fe(H2O)6]3+, d5(t32ge2g).
- Все комплексы, содержащие менее трех d-электронов, например [Ti(H2O)6]3+, d1; [V(phen)3]3+, d2; [CaEDTA]2-, d0.
Инертные комплексы
Октаэдрические d3-комплексы и низкоспиновые d4-, d5-, и d6-системы, например [Cr(H2O)6]3+, d3(t2g3); [Fe(CN)6]3-, d5(t2g5); [Co(NO2)6]3-, d6(t62g); [PtCl6]2-, d6(t62g).
Используя эту классификацию, можно предсказать, будет ли октаэдрический комплекс инертен или лабилен, если известны его магнитные свойства (высокоспиновый или низкоспиновый комплекс) и число d-электронов в центральном атоме.
Применение теории кристаллического поля позволяет разработать более подробную классификацию, нежели простое деление комплексов на "инертные" и "лабильные". Этот метод основан на сравнении энергии расщепления кристаллическим полем координационного соединения и его активного комплекса (вспомним, что под "активным комплексом" понимают конфигурацию исходных молекул, которая обеспечивает течение реакции без добавления энергии).
Если энергия расщепления кристаллическим полем исходного комплекса много больше аналогичной энергии для активного комплекса, то первый будет реагировать медленно; если различие мало, то реакция будет протекать быстро. Это различие влияет на скорость реакции, так как изменение энергии расщепления кристаллическим полем добавляется к энергии активации процесса. Если активный комплекс характеризуется меньшей стабилизацией кристаллическим полем, чем начальный комплекс, то потеря устойчивости активного комплекса увеличивает энергию активации реакции и, следовательно, уменьшает ее скорость.
Были проведены вычисления энергии расщепления кристаллическим полем октаэдрических и квадратно-пирамидальных активных комплексов (табл. 15). Из этих данных можно вычислить потерю в энергии расщепления кристаллическим полем при образовании активного комплекса. Это дает существенное доказательство того факта, что множество октаэдрических комплексов реагируют с образованием пятикоординационного промежуточного комплекса (разд. 7); однако эти вычисления следует рассматривать как грубое приближение, так как модель, на которой они основаны, нельзя считать строго правильной для некоторых реакций, и, конечно, она неправильна для многих реакций.
Таблица 15. Энергия стабилизации кристаллическим полем октаэдрических и квадратно-пирамидальных высокоспиновых комплексов
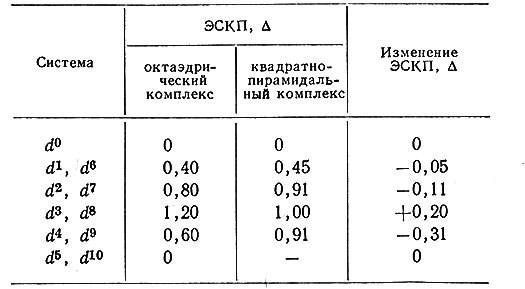
Таблица 15. Энергия стабилизации кристаллическим полем октаэдрических и квадратно-пирамидальных высокоспиновых комплексов
Данные табл. 15 показывают, что при переходе от октаэдрических d3- или d8-комплексов к квадратно-пирамидальным наблюдается заметная потеря энергии. Поэтому следует ожидать, что эти комплексы будут реагировать медленно, что в действительности и наблюдается. Все другие высокоспиновые комплексы будут реагировать быстро; это также имеет место в действительности. Аналогичные вычисления были сделаны для низкоспиновых комплексов. При применении таких вычислений для низкоспиновых и высокоспиновых комплексов оказалось, что скорости реакций аналогичных инертных комплексов будут уменьшаться в ряду d5>d4>d8 ~ d3> d6(d5-, d4- и d6-системы являются низкоспиновыми). Известны экспериментальные подтверждения этого вывода.
Рассматривая заряд и размеры центрального атома комплекса, можно также более детально охарактеризовать скорость реакций, в которые вступает данный комплекс. Правила, используемые для объяснения устойчивости комплексов (разд. 2 гл. V), часто успешно применимы и для объяснения их кинетического поведения. Небольшие высокозаряженные ионы образуют наиболее устойчивые комплексы; эти же ионы образуют комплексы, медленно вступающие в химические реакции. Таким образом, лабильность комплексов уменьшается с увеличением заряда центрального атома для изоэлектронной серии [AlF6]3->[SiF6]2->[PF6]->SF6. Аналогично скорость обмена воды (22) уменьшается с увеличением заряда катиона в ряду [Na(H2O)n]+>[Mg(H2O)n]2+>[Al[(H2O)6]3+.
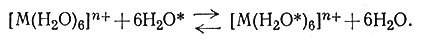
(22)
Комплексы с небольшим ионным радиусом центрального иона реагируют медленнее, чем с большим, например [Mg(H2O)6]2+<[Ca(H2O)6]2+<[Sr(H2O)6]2+. В серии октаэдрических комплексов с одними и теми же лигандами наиболее медленно реагируют комплексы с самым большим отношением заряда к радиусу. Правильность этого обобщения подтверждается данными скорости обмена воды, приведенными на рис. 35. Интересно отметить, что из комплексов переходных элементов первого ряда медленнее всего реагирует [Ni(H2O)6]2+ (d8-система), как и предсказано теорией кристаллического поля (гидраты ионов M2+ первого ряда переходных элементов - высокоспиновые комплексы). Большую скорость обмена [Cu(H20)6]2+ можно объяснить обменом молекул воды, расположенных выше и ниже плоскости квадрата в тетрагонально искаженном октаэдрическом комплексе. Оказалось, что четыре молекулы воды, расположенные в плоскости квадрата, реагируют значительно медленнее.
![Рис. 35. Период полуобмена воды для гидратированных ионов металлов. [По данным статьи M. Eigen, Pure Appl. Chem., 6, 105 (1963).] О - меченый кислород](pic/000263.jpg)
Рис. 35. Период полуобмена воды для гидратированных ионов металлов. [По данным статьи M. Eigen, Pure Appl. Chem., 6, 105 (1963).] О - меченый кислород
Четырехкоординационные комплексы (как тетраэдрические, так и плоские квадратные) реагируют в основном быстрее, чем аналогичные шестикоординационные системы. Выше было отмечено, что очень устойчивый комплекс [Ni(CN)4]2- быстро обменивается с 14CN- (20). Скорость же такого обмена для шестикоординационных комплексов, характеризующихся близкой устойчивостью, мала, например для [Mn(CN)6]4- и [Co(CN)6]3-. Большая скорость реакций с четырехкоординационными комплексами обусловлена, возможно, тем фактом, что в них вокруг центрального иона достаточно места для вхождения в координационную сферу пятой группы. Наличие этой дополнительной группы будет способствовать вытеснению одного из первоначальных лигандов.
Для плоских квадратных комплексов не представляется возможным успешно применить широко разработанное для шестикоординационных комплексов обобщение об отношении заряда к радиусу. Так, для подгруппы никеля размер М2+ионов увеличивается с повышением атомного номера, а скорость реакций уменьшается в ряду Ni2+>Pd2+>Pt2+. Скорость обмена Cl- в [AuCl4]- на *Cl- примерно в 104 раз больше, чем для [PtCl4]2-, хотя по величине заряда ионов металлов можно было ожидать обратный порядок.
Как ранее было отмечено, скорость реакции зависит от ее механизма, т. е. от конфигурации и энергии активного комплекса, а следовательно, и от энергии активации. Для октаэдрических систем на энергию активации в большей степени оказывает влияние разрыв связи металл - лиганд; поэтому большой положительный заряд центрального иона замедляет отрыв лиганда. В четырехкоординационных системах образование новых связей металл - лиганд имеет очень важное значение, а большой положительный заряд центрального иона способствует этому.
Таким образом, правила, предсказывающие величину скорости реакций для шестикоординационных систем, часто не применимы для комплексов с меньшими координационными числами. Так как скорость зависит от механизма реакции и поскольку известно, что реакции комплексов могут протекать различными путями, то нельзя сделать обобщение, применимое ко всем комплексам независимо от типа реакции, в которые они вступают. Несмотря на это, правила, описанные в рассматриваемом разделе, удивительно согласуются с данными по скорости реакций октаэдрических комплексов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'