
8. Механизм окислительно-восстановительных реакций
Теперь нужно рассмотреть другую категорию реакций с координационными соединениями - окислительно-восстановительные реакции. Окислительно-восстановительными называются такие реакции, в которых изменяется степень окисления атомов. В реакции (40) степень окисления кобальта уменьшается от 3 до 2 (кобальт восстанавливается), а степень окисления хрома увеличивается от 2 до 3 (хром окисляется).
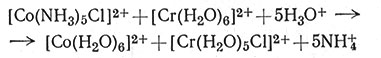
(40)
Изменение степени окисления означает, что электрон от Cr(II) переходит к Со(III) [уравнения (41), (42)]. Механизм этой реакции должен объяснить, каким путем осуществляется переход этого электрона. Здесь возможны два пути:
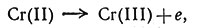
(41)
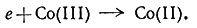
(42)
По одному из них электрон перескакивает от одной частицы к другой. Он называется механизмом перехода электрона или механизмом внешнесферного активного комплекса. По другому пути окислитель и восстановитель могут соединиться между собой мостиковой молекулой, атомом или ионом, по которому проходит электрон. Такой путь называют механизмом атомного перехода или механизмом мостикового активного комплекса.
Таубе с сотрудниками осуществили изящный эксперимент, демонстрирующий правильность второй концепции. Реакция (40) - одна из наиболее изученных; было обнаружено, что при восстановлении Cr2+ комплекса [Co(NH3)5Cl]2+ получающееся соединение хрома(III) всегда содержит ион хлора. Для более детального изучения этой реакции комплекс [Co(NH3)6Cl]2+, меченный радиоактивным изотопом 36Cl-, помещали в раствор, содержащий Cr2+ и обычные ионы Cl-. После восстановления, которое проходило очень быстро, продукт реакции [Cr(H2O)5Cl]2+ анализировали и обнаружили, что он содержит ионы хлора, меченные 36Cl-. Это доказывало, что только комплекс кобальта был источником меченых ионов Cl-, обнаруженных в комплексе хрома(III). Для объяснения этого результата был предложен механизм реакции (I), по которому активный комплекс имеет атомы хрома и кобальта, связанные ионом хлора. Хлоридный мостик обеспечивает переход электрона между двумя атомами металлов, подобно медной проволоке, соединяющей два электрода. Как только электрон переходит от Cr(II) к Co(III), образующийся Cr(III) притягивает ион Cl- сильнее, чем Со(II), и поэтому Cl- входит в комплекс Cr(III). Прямой переход электронов от комплекса хрома к комплексу кобальта, сопровождающийся переходом 36Cl-, кажется маловероятным, так как если бы это было так, то немеченый Cl- из раствора входил бы в комплекс Cr(III) так же легко, как и 36Cl- в комплекс кобальта.
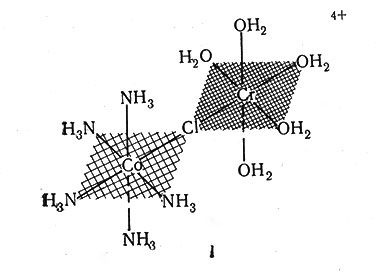
Реакцию (40) и аналогичные ей реакции обычно выбирают для подобного исследования из-за инертности комплексов Со(III) и Cr(III) и лабильности комплексов Со(II) и Cr(II). Таким образом, быстрая окислительно-восстановительная реакция заканчивается задолго до начала реакции замещения в комплексах Cr(III) и Со(III). Лабильность комплекса [Cr(H2O)6]2+ обеспечивает быстрый отрыв молекул воды и образование промежуточного мостикового соединения (I). Полученные результаты требуют такого механизма реакции, по которому координированные ионы хлора никогда не выделялись бы в раствор, так как в последнем случае образовывались бы заметные количества [Cr(H2O)6]3+ и немеченого [Cr(H2O)5Cl]2+. Механизм же, по которому ион 36Cl- соединяет атомы Cr и Co для перехода электронов, очень хорошо согласуется с экспериментальными данными.
Были изучены реакции с рядом комплексов трехвалентного кобальта ([Co(NH3)5X]2+) в растворе, содержащем соединения хрома(II), и было найдено, что переход группы Х- к атому хрома происходит в том случае, если X- = NCS-, N-3, PO43-, C2H3O-2, Cl-, Br- и SO42- (43). Это позволяет предположить, что все эти реакции протекают по механизму атомного перехода.
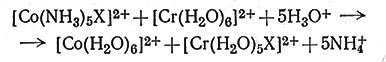
(43)
Скорости этих реакций возрастают в ряду C2H3O2-<SO2-4<Cl-<Br-. По-видимому, самые быстрые реакции вызывают те ионы, которые легче всего образуют мостики и которые обеспечивают для перехода электронов надежный путь. Интересно, что комплекс
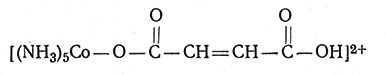
легче восстанавливается соединением хрома(II), в то время как восстановление комплекса
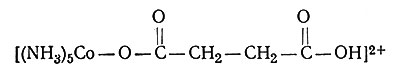
протекает очень медленно. Это различие обусловлено тем, что, несмотря на образование обеими группами мостиков между атомами Co и Cr, органическая группа, содержащая двойную связь, оказывается лучшим проводником электронов.
Окислительно-восстановительные реакции, идущие по механизму перехода электронов по мостиковой группе, часто встречаются. В приведенных выше реакциях окислительно-восстановительный процесс сопровождается переходом и мостикового атома. Последнее не является обязательным условием такого механизма реакции, но без этого трудно определить, включает ли процесс передачи электронов участие мостикового атома или нет. Известно большое число окислительно-восстановительных реакций комплексов, протекающих, вероятно, по механизму непосредственной передачи электронов. Скорость реакции (44)
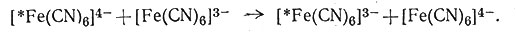
(44)
(которая в действительности вовсе и не является реакцией) можно изучить введением в комплекс либо радиоактивного изотопа Fe, либо 14С; реакция идет очень быстро.
Ферро- и феррицианид-ионы инертны ([Fe(CN)6]4- является низкоспиновой d6-системой; [Fe(CN)6]3- - низкоспиновой d5-системой); поэтому диссоциация, или реакция обмена ионов CN-, или какие-либо реакции замещения идут очень медленно. Тот факт, что окислительно-восстановительная реакция идет очень быстро, в то время как реакции замещения протекают медленно, безусловно, исключает возможность передачи электрона через мостиковый активный комплекс, так как образование активного комплекса сводится к процессу замещения.
Если исключить мостиковый механизм, то остается только непосредственная передача электронов. С теоретической точки зрения имеются серьезные замечания относительно этого процесса. В соответствии с принципом Франка - Кондона в процессе перехода электрона существенно не меняется пространственное расположение атомов, так как очень легкие электроны перемещаются много быстрее тяжелых атомов. Рассмотрим применение этого принципа к процессу непосредственной передачи электронов. Лиганды могут ближе подойти к меньшему иону Fe3+, чем к большему по размеру Fe2+ (II).
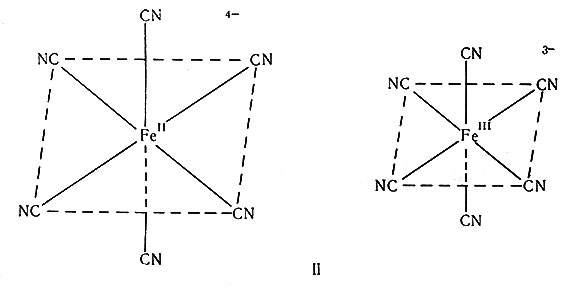
При переходе электрона от [Fe(CN)6]4- к [Fe(CN)6]3- ни один из атомов Fe, С или N не успеет сместиться. Поэтому результатом перехода электрона явится образование [Fe(CN)6]3-, у которого связи Fe - С окажутся слишком длинными, и [Fe(CN)6]4-, у которого связи Fe - С будут слишком короткими. Оба продукта реакции обладают большей энергией по сравнению с нормальными ионами, в которых связи Fe - С имеют определенную длину (длину, которая соответствует наиболее низким значениям энергии).
Описанный выше процесс напоминает перпетуум-мобиле. Вначале были ионы [Fe(CN)6]3- и [Fe(CN)6]4-; между ними осуществляется переход электрона, и тут же получаются те же два иона, но с избытком энергии. Но процесс, в котором происходит только увеличение энергии, не может осуществляться, и, следовательно, такое описание реакции ошибочно. Реакция может идти только в том случае, если системе сообщено по крайней мере такое же количество энергии, сколько было у нее отнято. Следовательно, прежде чем произойдет передача электрона, связи Fe - С в комплексе [Fe(CN)6]4- должны укоротиться, а в [Fe(CN)6]3- удлиниться, а для этого системе необходимо сообщить некоторое количество энергии. Для осуществления этой реакции геометрическое строение ионов [Fe(CN)6]3- и [Fe(CN)6]4- должно быть аналогичным. Тогда продукты реакции и исходные ионы при переходе электрона будут эквивалентны и в результате такого процесса не будет получаться избыточная энергия.
Рассматривая количество энергии, необходимое для того, чтобы окислитель и восстановитель имели близкое строение, можно понять скорость многих реакций с непосредственным переходом электрона. Так как [Fe(CN)6]3- и [Fe(CN)6]4- до некоторой степени похожи, то относительно небольшое добавление энергии (энергии активации) сделает эти ионы неразличимыми; таким образом, переход электрона может происходить быстро. Реакция (45) идет очень медленно.

(45)
Комплексы [Co(NH3)6]2+ и [Co(NH3)6]3+ мало различаются по размерам, а следовательно, можно ожидать, что обмен электроном между ними будет идти быстро. Однако оба комплекса различаются электронными конфигурациями; [Co(NH3)6]2+ имеет конфигурацию t52geg2, а [Co(NH3)6]3+ - t62g. Следовательно, у обоих комплексов до перехода электрона должны измениться длина связей Со - N и электронная конфигурация. Это и является причиной очень медленного течения реакции.
Кроме того, на скорость непосредственного перехода электрона влияют и другие факторы; например, чем больше проводимость лигандов, тем легче электрон будет переходить от одного комплекса к другому. Следует ожидать, что цианид-ионы будут хорошо осуществлять передачу электронов, и, действительно, было найдено, что в большинстве похожих цианидных комплексов переход электронов между комплексами был очень быстрым. То же справедливо для хорошо проводящих систем [M(phen)3]n+ и [M(bipy)3]n+ по сравнению с [M(en)3]n+ и [M(NH3)6]n+.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'