
7. Реакции замещения в плоских квадратных комплексах
Для комплексов с координационным числом металла менее шести наиболее вероятным будет механизм замещения SN2. Лучше всего изучены комплексы Pt(II) с координационным числом четыре. Для этого случая известно экспериментальное доказательство механизма SN2. Скорости реакций с некоторыми комплексами Pt(II), имеющими различные заряды, приведены в табл. 16. В этой серии комплексов заряд исходного комплекса Pt(II) меняется от 2- до 1+, а скорость возрастает только в два раза (очень незначительный эффект). Разрыв связи Pt - Cl сильно затрудняется с увеличением положительного заряда комплекса, и образование новой связи становится более благоприятным. Незначительное влияние заряда комплекса на скорость реакции предполагает, что важны как образующаяся, так и разрывающаяся связи, и это характерно для SN2-процесса.

Таблица 16. Скорость некоторых реакций с комплексами Pt(III)
Хорошим доказательством внедрения лиганда во внутреннюю координационную сферу служит второй порядок реакции: первый - по комплексу Pt(II) и первый - по внедряющемуся лиганду. Эта закономерность установлена для реакций с различными комплексами Pt(II) и с разнообразными лигандами. Небольшая сложность возникает оттого, что вода как растворитель также может быть потенциальным лигандом. В результате скорость реакции типа (38) подчиняется уравнению, содержащему два слагаемых (39); это указывает на то, что реакция протекает
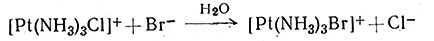
(38)
по двум механизмам, из которых только в один входит Br-
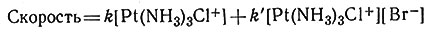
(39)
в стадии, определяющей скорость реакции. Эксперименты с комплексами Pt(II) позволяют предположить, что механизм реакции, в который не входит Br-, не является SN1-процессом; было сделано допущение, что молекула H2O из растворителя замещает ион Cl- в медленной стадии с последующей ее заменой ионом Br- (быстрая стадия). Предположенный механизм приведен на рис. 36. Участие растворителя до некоторой степени было продемонстрировано опытами проведения аналогичных реакций с различными растворителями. В растворителях, являющихся плохими лигандами (CCl4, С6Н6), был установлен второй порядок реакции, и внедряющийся лиганд, по-видимому, непосредственно входит в комплекс; в растворителях, являющихся хорошими лигандами (Н2O, спирты), механизм с реакцией первого порядка входит в общий процесс.
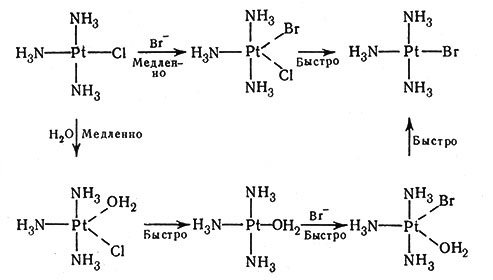
Рис. 36. Механизм реакции (38)
В реакциях замещения как с плоскими квадратными комплексами платины(II), так и с октаэдрическими комплексами кобальта(III) очень заметно влияние растворителя. Следует помнить, что во всех реакциях, проходящих в растворах, растворитель играет важную роль. Так, поведение комплекса в воде может заметно отличаться от его поведения в другом растворителе.
В настоящее время общепризнано, что плоские квадратные комплексы Pt(II) реагируют по механизму SN2. Несмотря на то что по кинетике реакций замещения с другими квадратными комплексами известно мало работ, кажется вероятным, что и в этих системах процессы SN2 также будут преобладать. Если внедряющийся лиганд оказывает влияние на величину скорости реакции, то важно узнать, какой лиганд промотирует самую быструю реакцию.
Изучение скорости реакций позволяет заключить, что лиганды, оказывающие сильное транс-влияние (разд. 8 гл. IV), быстро присоединяются к комплексам платины (II). Такие группы, как фосфины, SCN- и I-, быстро реагируют с комплексами Pt(II); амины, Br-, Cl- реагируют со средней скоростью; вода и ОН- реагируют медленно. Это свойство отражает частично нуклеофильность (притяжение к положительно заряженному центру) этих групп и показывает, что ОН- - плохой нуклеофильный реагент, по крайней мере в отношении платины(II). Надо отметить, однако, что порядок реакционной способности явно не является указателем только на притяжение лигандов к положительно заряженному центру. Если бы это было так, то Cl- реагировал бы быстрее, чем более крупные по объему анионы Br- и I-. Наблюдаемый порядок реакционной способности можно объяснить легкостью, с которой внедряющийся лиганд может отдать свои электроны Pt(II). Иод-ион легче отдает электроны, чем Cl-. Установлено хорошее соответствие между реакционной способностью внедряющейся группы и ее окислительным потенциалом. Вообще чем легче окисляется группа, тем быстрее реагирует она с комплексами платины(II).
Для тетраэдрических комплексов имеются очень ограниченные сведения о механизмах и скоростях реакций. Эти комплексы необычайно похожи на октаэдрические, и их реакции замещения часто протекают очень быстро. Возможно, что быстрое течение этих реакций частично указывает на наличие механизма SN2. Требуемая для реакции энергия (энергия активации) будет уменьшаться, если внедряющаяся группа может способствовать разрыву связи металл - лиганд.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'