
6. Реакции замещения в октаэдрических комплексах
Основная реакция замещения в водных растворах - обмен молекул воды (22) - была изучена для большого числа ионов металлов (рис. 34). Обмен молекул воды координационной сферы иона металла с основной массой молекул воды, присутствующей в качестве растворителя, для большинства металлов протекает очень быстро, и поэтому скорость такой реакции удалось изучить главным образом методом релаксации. Метод заключается в нарушении равновесия системы, например резким повышением температуры. При новых условиях (более высокой температуре) система уже не будет находиться в равновесии. Затем измеряют скорость установления равновесия. Если можно изменить температуру раствора в течение 10-8 сек, то можно измерить скорость реакции, которая требует для своего завершения промежутка времени больше чем 10-8 сек.
Можно измерить также скорость замещения координированных молекул воды у различных ионов металлов лигандами SO2-4, S2O32-, EDTA и др. (26). Скорость такой реакции
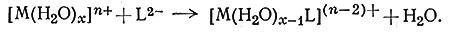
(26)
зависит от концентрации гидратированного иона металла и не зависит от концентрации входящего лиганда, что позволяет использовать для описания скорости этих систем уравнение первого порядка (27). Во многих случаях скорость реакции (27) для данного иона металла не зависит от природы входящего лиганда (L), будь то молекулы H2O или ионы SO42-, S2O32- или EDTA.
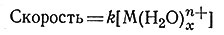
(27)
Это наблюдение, а также тот факт, что в уравнение скорости этого процесса не включена концентрация входящего лиганда, позволяют предполагать, что эти реакции протекают по механизму, в котором медленная стадия заключается в разрыве связи между ионом металла и водой. Получающееся соединение, вероятно, затем быстро координирует находящиеся поблизости лиганды.
В разд. 4 данной главы было указано, что более высокозаряженные гидратированные ионы металла, такие, как Al3+ и Sc3+, обменивают молекулы воды медленнее, чем ионы M2+ и M+; это дает основание предполагать, что в стадии, определяющей скорость всего процесса, важную роль играет разрыв связей. Выводы, полученные в этих исследованиях, не окончательны, но они дают основание думать, что в реакциях замещения гидратированных ионов металлов важное значение имеют SN1-процессы.
Вероятно, самыми изученными комплексными соединениями являются аммины кобальта(III). Их устойчивость, легкость приготовления и медленно текущие с ними реакции делают их особенно удобными для кинетического изучения. Так как исследования этих комплексов были проведены исключительно в водных растворах, вначале следует рассмотреть реакции этих комплексов с молекулами растворителя - воды. Было установлено, что вообще молекулы аммиака или аминов, координированные ионом Co(III), настолько медленно замещаются молекулами воды, что обычно рассматривают замещение иных лигандов, а не аминов.
Была изучена скорость реакций типа (28) и найдено, что она первого порядка относительно комплекса кобальта (X - один из множества возможных анионов).
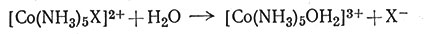
(28)
Так как в водных растворах концентрация H2O всегда равна примерно 55,5 М, то нельзя определить влияние изменения концентрации молекул воды на скорость реакции. Уравнения скорости (29) и (30) для водного раствора экспериментально не различимы, так как к просто равно k'[H2O] = k'[55,5]. Следовательно, по уравнению скорости реакции нельзя сказать, будет ли H2O участвовать в стадии, определяющей скорость процесса. Ответ на вопрос, протекает ли эта реакция по механизму SN2 с заменой иона X на молекулу H2O или по механизму SN1, предусматривающему вначале диссоциацию с последующим присоединением молекулы H2O, нужно получить при помощи других экспериментальных данных.
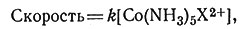
(29)
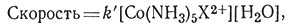
(30)
Решения этой задачи можно добиться двумя типами экспериментов. Скорость гидролиза (замещение одного иона Cl- на молекулу воды) транс-[Co(NH3)4Cl2]+ примерно в 103 раз больше скорости гидролиза [Co(NH3)5Cl]2+. Увеличение заряда комплекса приводит к усилению связей металл - лиганд, а следовательно, и к торможению разрыва этих связей. Следует также учитывать притяжение входящих лигандов и облегчение протекания реакции замещения. Так как обнаружено уменьшение скорости по мере увеличения заряда комплекса, то в данном случае кажется более вероятным диссоциативный процесс (SN1).
Другой способ доказательства основан на изучении гидролиза серии комплексов подобных транс-[Co(en)2Cl2]+. В этих комплексах молекула этилендиамина заменена аналогичными диаминами, в которых атомы водорода у атома углерода замещены на группы CH3. Комплексы, содержащие замещенные диамины, реагируют быстрее, чем этилендиаминный комплекс. Замена атомов водорода на CH3-группы увеличивает объем лиганда, что затрудняет атаку атома металла другим лигандом. Эти стерические препятствия замедляют реакцию по механизму SN2. Наличие вблизи атома металла объемистых лигандов способствует диссоциативному процессу, так как удаление одного из лигандов понижает их скопление у атома металла. Наблюдаемое увеличение скорости гидролиза комплексов с объемистыми лигандами является хорошим доказательством протекания реакции по механизму SN1.
Итак, в результате многочисленных исследований ацидоаминных комплексов Co(II) оказалось, что замена ацидогрупп молекулами воды является по своему характеру диссоциативным процессом. Связь атом кобальта - лиганд удлиняется до некоторой критической величины прежде, чем молекулы воды начнут входить в комплекс. В комплексах, имеющих заряд 2+ и выше, разрыв связи кобальт - лиганд весьма затруднен, и вхождение молекул воды начинает играть более важную роль.
Было обнаружено, что замена ацидо-группы (Х-) в комплексе кобальта(III) на иную группу, чем молекула H2O, (31) проходит вначале через замещение ее молекулой
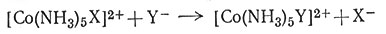
(31)
растворителя - воды с последующей заменой ее на новую группу Y (32).
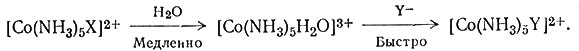
(32)
Таким образом, во многих реакциях с комплексами кобальта(III) скорость реакции (31) равна скорости гидролиза (28). Только ион гидроксила отличается от других реагентов в отношении реакционной способности с амминами Co(III). Он очень быстро реагирует с амминными комплексами кобальта(III) (примерно в 106 раз быстрее, чем вода) по типу реакции основного гидролиза (33).
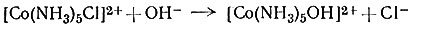
(33)
Найдено, что эта реакция первого порядка относительно замещающего лиганда OH- (34). Общий второй порядок реакции и необычно быстрое протекание реакции позволяют предположить, что ион OH- - исключительно эффективный нуклеофильный реагент по отношению к комплексам Co(III) и что реакция протекает по механизму SN2 через образование промежуточного соединения.
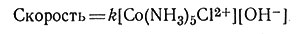
(34)
Однако это свойство OH- можно также объяснить и другим механизмом [уравнения (35), (36)]. В реакции (35) комплекс [Co(NH3)5Cl]2+ ведет себя как кислота (по Бренстеду), давая комплекс [Co(NH3)4NH2Cl]+, который является амидо-(содержащим 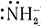 )-соединением - основанием, соответствующим кислоте [Co(NH3)5Cl]2+.
)-соединением - основанием, соответствующим кислоте [Co(NH3)5Cl]2+.

(35)

(36)
Затем реакция протекает по механизму SN1 (36) с образованием пятикоординационного промежуточного соединения, далее реагирующего с молекулами растворителя, что приводит к конечному продукту реакции (37). Этот механизм реакции согласуется со скоростью реакции второго порядка и отвечает механизму SN1. Так как реакция в стадии, определяющей скорость, включает основание, сопряженное первоначальному комплексу - кислоте, то этому механизму дано обозначение SN1СВ.
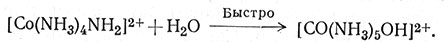
(37)
Определить, какой из этих механизмов лучше всего объясняет экспериментальные наблюдения, очень трудно. Однако есть убедительные доказательства, подтверждающие гипотезу SN1CB. Лучшие аргументы в пользу этого механизма следующие: октаэдрические комплексы Со(III) вообще реагируют по диссоциативному механизму SN1, и нет никаких убедительных доводов, почему бы ион OH- должен обусловить процесс SN2. Установлено, что ион гидроксила - слабый нуклеофильный реагент в реакциях с Pt(II), и поэтому кажется беспричинной его необычная реакционная способность по отношению к Co(III). Реакции с соединениями кобальта(III) в невоДных средах служат прекрасным доказательством образования пятикоординационных промежуточных соединений, предусматриваемых механизмом SN1 СВ.
Окончательным же доказательством является тот факт, что при отсутствии в комплексе Co(III) связей N - Н он медленно реагирует с ионами ОН-. Это, конечно, дает основание считать, что для скорости реакции кислотно-основные свойства комплекса важнее нуклеофильных свойств ОН". Эта реакция основного гидролиза амминных комплексов Со(III) является иллюстрацией того факта, что кинетические данные часто можно интерпретировать не только одним способом, и, чтобы исключить тот или иной возможный механизм, нужно осуществить довольно тонкий эксперимент.
В настоящее время исследованы реакции замещения большого числа октаэдрических соединений. Если рассмотреть их механизмы реакций, то чаще всего встречается диссоциативный процесс. Этот результат не является неожиданным, так как шесть лигандов оставляют мало места вокруг центрального атома для присоединения к нему других групп. Известно лишь немного примеров, когда доказано возникновение семикоординационного промежуточного соединения или обнаружено влияние внедряющегося лиганда. Поэтому SN2 механизм нельзя полностью отвергнуть в качестве возможного пути реакций замещения в октаэдрических комплексах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'