
Приложение
1 (Нормальными условиями газа называются температура 0° С или 273° К. давление 1 атм или 760 мм рт. ст.
Пересчет на нормальные условия производится по объединенному уравнению для законов Бойля-Мариотта и Гей-Люссака
pV = p0*V0/T0T.
)
2 (Так как объемы моля всех веществ при одинаковых условиях одинаковы, то при реакциях между газами объемы участвующих в них газов относятся как коэффициенты в уравнении реакции.)
3 (Из закона Гесса следует, что теплота химической реакции равняется сумме теплот разложения исходных веществ и теплот образования получаемых веществ. Теплота разложения равна теплоте образования, взятой с обратным знаком. В соответствии с этим
-qСаСO3 + qСаО + qСO2 = -200,8
qСаСО3 = 200,8 + 636,3 + 405,9 = 1252 (кдж).
)
4 (Задачи этого раздела надо решать, не пользуясь таблицей Д. И. Менделеева.)
5 (Расчет производится путем последовательного вычитания из порядкового номера элемента числа элементов в периодах, начиная с первого, пока разность не окажется меньше количества элементов в последующем периоде.
Пример. Найти период, ряд и группу, в которой находится элемент с порядковым номером 16. Последовательно вычитая из 16 количества элементов в первом и втором периодах, получаем разность 6, которая меньше количества элементов в третьем периоде. Отсюда заключаем, что рассматриваемый элемент находится в третьем периоде в VI группе.)
6 (В первых трех группах все элементы, за исключением бора, являются металлами. В последующих группах, включая VIII, металлами являются все элементы первых (четных) рядов больших периодов.)
7 (Процесс образования ионов из атомов путем отдачи или принятия электронов может быть выражен электронно-ионными уравнениями, например:
- образование иона Ni2+ из атомов выражается уравнением Ni - 2e = Ni2+;
- образование иона Se2- из атомов селена - уравнением Se + 2e = Se2-.
)
8 (Расчет может быть произведен по правилу смешения, согласно которому количества составных частей в двухкомпонентной смеси обратно пропорциональны разностям свойств смеси и отдельных компонентов. В рассматриваемом случае свойством смеси является атомная масса элемента, а свойствами компонентов - массовые числа изотопов.
В соответствии с этим отношение количества изотопов хлора в природном хлоре выразится следующим образом:
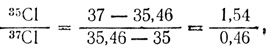
Чтобы выразить это отношение в процентах, нужно 100% разделить пропорционально числам найденного отношения:
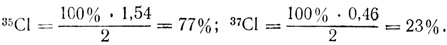
)
9 (Составление уравнений ядерных реакций подобно составлению уравнений химических реакций. В левой части уравнения записываются символы исходных частиц, а в правой части - символы получающихся частиц.
Ядерные реакции подчиняются закону, согласно которому сумма массовых чисел исходных частиц должна быть равной сумме массовых чисел получающихся частиц. Точно так же сумма ядерных зарядов исходных частиц должна равняться сумме ядерных зарядов получающихся частиц. Это дает возможность установить, какие изотопы получаются в результате ядерных реакций.
Пример. При бомбардировке α-частицами (ядрами гелия 12Не) изотопа азота 147N получается изотоп водорода 11Н и изотоп еще какого-то элемента. Определить, что это за изотоп.
Записываем схему реакции:
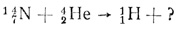
Из нее видно, что массовое число получаемого изотопа 17, а заряд ядра 8. Значит, это изотоп кислорода 178O.)
10 (Предварительно следует, пользуясь плотностью, перечислить объем раствора на его массу.)
11 (Расчет может быть произведен по правилу смешения.
Свойством смеси и смешиваемых растворов, по которому производится расчет, является концентрация раствора. Количества смешиваемых растворов обратно пропорциональны разностям концентрации смеси и смешиваемых растворов. Отсюда:
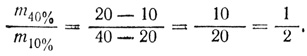
Так как 40-процентного раствора было 500 г, то 10-процентного раствора надо было взять в 2 раза больше, т. е. 1000 г. При оформлении решения посредством диагональной схемы получаем:
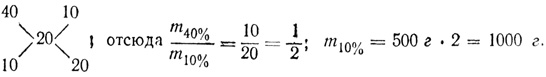
)
12 (Следует предварительно пересчитать объем 20-процентного раствора на его массу и, пользуясь правилом смешения, вычислить массу 4-процентного раствора, Затем, пользуясь плотностью, пересчитать найденную массу 4-процентного раствора на его объем.)
13 (Концентрация воды принимается равной нулю.)
14 (Для определения количества раствора, необходимого для реакции, предварительно вычисляют массу растворенного вещества. Затем по найденной массе и заданной концентрации раствора вычисляют количество раствора.
Пример. Сколько 5-процентного раствора гидроокиси натрия расходуется при реакции с 2 г хлорида меди?
Решение:
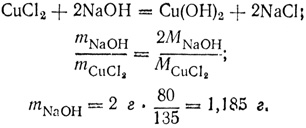
По найденному количеству хлорида натрия и заданной концентрации раствора вычисляют количество раствора:
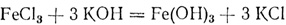
Если оба реагирующих вещества находятся в растворе, то раньше вычисляют массу того реагирующего вещества, количество раствора которого известно. Затем по уравнению реакции находят массу второго из реагирующих веществ и наконец по найденной массе второго реагирующего вещества и концентрации его раствора вычисляют количество этого раствора.)
15 (Молярная концентрация раствора показывает, сколько молей растворенного вещества содержится в 1 л раствора. Отсюда следует, что для расчета массы растворенного вещества, содержащегося в данном объеме раствора, надо предварительно вычислить, сколько молей содержится в нем, а затем найденное количество молей пересчитать на граммы. Наоборот, когда известны масса растворенного вещества и объем раствора и требуется определить молярность раствора, надо массу растворенного вещества пересчитать на моли и определить, сколько молей растворенного вещества содержится в литре раствора.
Пример. Сколько серной кислоты требуется для приготовления 2,5 л 0,1 М раствора?
Умножая молярность раствора на его объем, находим, что в указанном растворе должно содержаться 0,25 моль. Так как моль H2SO4 равняется 98 г, то в приготовленном растворе серной кислоты должно содержаться:
m = 98г*0,25 = 24,5 г.
)
16 (Чтобы вычислить количество молекул растворенного вещества, содержащегося в данном объеме раствора, надо найти, сколько молей содержится в нем, а затем умножить число Авогадро на найденное количество молей.
Пример. Сколько молей содержится в 25 см3 0,002 М раствора? Из понятия о молярности раствора следует, что γ (количество молей в растворе) = cV (где V - объем в литрах, с - концентрация).
В соответствии с этим для данной задачи γ = 0,002 моль/л * 0,025 л = 0,00005 моль = 5*10-5 моль. Отсюда: N (число молекул) = 6,02*1033*5*10-5 = 30,1*1018 = 30100000000000000000 молекул.)
17 (Задача решается методом, применяемым при смешивании процентных растворов.)
18 (При одинаковой молярности объемы взаимодействующих растворов прямо пропорциональны относительному количеству молекул реагирующих веществ. При разной молярности объемы растворов, кроме того, обратно пропорциональны молярности растворов,
Пример 1. В каком отношении должны быть взяты для реакции объемы растворов хлорида алюминия и нитрата серебра при одинаковой молярности их?
Из уравнения реакции
AlCl3 + 3AgNO3 = Al(NO3)3 + 3AgCl
следует, что молекул AlCl3 должно быть взято в 3 раза меньше, чем молекул AgNO3. А так как при одинаковой молярности в одинаковых объемах растворов содержится одинаковое количество молекул, то объем раствора AlCl3 должен быть в 3 раза меньше объема раствора AgNO3.
Пример 2. Вычислить объем 0,5 М раствора гидроокиси калия, который требуется для реакции с 20 см3 0,2 М раствора хлорного железа.
Из уравнения реакции
FeCl3 + 3KOH = Fe(OH)3 + 3KCl
видно, что при одинаковой молярности растворов следовало бы взять объем раствора гидроокиси калия в 3 раза больше объема хлорного железа. Но так как молярность раствора гидроокиси калия в 2,5 раза больше молярности раствора хлорного железа, то объем раствора гидроокиси калия должен быть взят в 2,5 раза меньше, чем при одинаковой молярности растворов. Отсюда
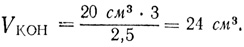
)
19 (Массу H2SO4 в 1 л раствора надо пересчитать на количество грамм-эквивалентов.)
20 (Вычислить, сколько грамм-эквивалентов содержится в 20 г хлорида кальция, и определить, в каком объеме 2 н. раствора содержится такое количество грамм-эквивалентов.)
21 (При химических реакциях объемы и нормальность растворов обратно пропорциональны друг другу, т. е.
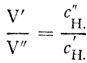
)
22 (Как ни была мала растворимость практически нерастворимых гидроокисей в водном растворе, они диссоциируют на ионы. Основания, молекулы которых содержат две и более гидроксильных групп, диссоциируют ступенчато, аналогично тому как диссоциируют много-основные кислоты. Например, гидроокись магния диссоциирует следующим образом:
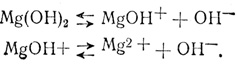
)
23 (Следует предварительно вычислить число молей, содержащихся в указанном объеме раствора. Затем, пользуясь степенью диссоциации, вычислить, сколько молей находится в растворе в виде ионов. После этого пересчитать найденное число молей на массу и определить, как распределяется найденная масса между одними и другими ионами,
Пример. Вычислить массу ионов Zn2+ и NO3-, содержащихся в 260 мл 0,1 М раствора нитрата цинка Zn(NO3)2.
Из молярности раствора и его объема находим, что в растворе содержалось молей:
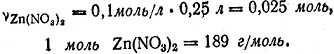
Отсюда вычисляем массу нитрата цинка:
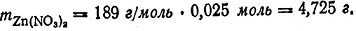
Так как нитрат цинка - сильный электролит, то вся масса его находилась в растворе в виде ионов, масса которых распределяется следующим образом:
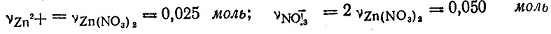
Отсюда:

Если электролит средней силы или слабый, нужно найденное число молей умножить на степень диссоциации и в дальнейшем вести расчет, как показано.)
24 (Некоторые электролиты в водном растворе распадаются на ионы полностью. Такие электролиты называются сильными.
Другие электролиты распадаются на ионы лишь частично, притом в различной степени. Степень распада электролита на ионы называется степенью электролитической диссоциации и обычно обозначается буквой а. Степень электролитической диссоциации выражается или в процентах или дробью. Например α = 20% означает, что в водном растворе лишь 20% электролита находятся в виде ионов; остальные 80% в виде молекул. Эта же степень диссоциации может быть выражена дробью 1/5.
Электролиты, степень диссоциации которых мала (не больше 5%), считаются слабыми. Щелочи и растворимые соли относятся к сильным электролитам.)
25 (Соли состоят из положительных и отрицательных ионов. Положительными ионами в соли являются ионы металлов или основные остатки, образованные соединением ионов металлов с гидроксильными ионами, как, например, MgOH+, Al(OH)2+, FeOH2+. Отрицательными ионами в солях являются ионы кислотных остатков. В зависимости от типа положительных и отрицательных ионов соли делятся на:
- средние, или нормальные, если они состоят из ионов металлов и кислотных остатков, не содержащих водород (водород кислоты полностью замещен металлом), например Na2SO4;
- кислые, если они состоят из ионов металлов и кислотных остатков, содержащих водород (водород кислоты лишь частично замещен металлом), например NaHSO4;
- основные, если положительные ионы являются остатками, содержащими гидроксильные группы, например (CuOH)2SO4.
)
26 (Ионы Н+ обусловливают кислотные свойства раствора, а ионы ОН- щелочные свойства его. При одинаковой концентрации ионов Н+ и ОН-, равной 10-7моль/л, раствор нейтральный. Если концентрация ионов Н+ больше - раствор кислый, а если больше концентрация ионов ОН- - раствор щелочной.
В водном растворе при 22° С [Н+]*[ОН-] = 10-14 и, следовательно, сумма рН + рОН = 14.
Таким образом, по концентрации ионов Н+ или ОН- можно судить о кислотности или щелочности раствора. Но так как концентрация этих ионов взаимозависима, то для определения характера среды раствора нет необходимости в измерении концентрации тех и других ионов. Для этого достаточно измерить концентрацию одного из них. О характере среды раствора принято судить по концентрации в нем водородных ионов. При этом для простоты принято вместо самой концентрации указывать показатель степени этой концентрации. Но так как показатель степени отрицательный, решено брать его с обратным знаком. Это и есть рН раствора. Например, концентрация водородных ионов 10-5 рН раствора 5; концентрация водородных ионов 10-8 - раствора 8 и т. д. Пользуясь рН раствора, очень удобно выражать фактор среды его (степень Кислотности или щелочности), а именно: при рН, равном 7, раствор нейтральный, при рН меньше 7 раствор кислый, и тем более кислый, чем меньше рН; при рН больше 7 раствор елочной, и тем более щелочной, чем больше рН.)
27 (При погружении металлов в раствор его соли на границе металл-раствор возникает скачок потенциала. Величина этого скачка зависит от активности металла и концентрации его ионов в растворе. Измеренные при стандартных условиях эти потенциалы служат мерилом активности металлов, т. е. способности их отдавать электроны.
Ряд металлов, расположенных по величине их стандартных потенциалов, образует электрохимический ряд напряжений металлов. Чем больше отрицательное значение потенциала и чем меньше положительное значение его, тем больше активность металла, В ряд электрохимических напряжений включается также водород, потенциал которого принимается за нуль.
Электрохимический ряд напряжений для важнейших металлов
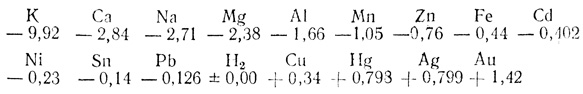
)
28 (При соединении металлическим проводником двух металлов, погруженных в растворы своих солей, электроны от более активного металла начинают перемещаться по наружному Проводнику к менее активному. Первый, теряя электроны, окисляется, а ионы второго, содержащиеся в растворе, принимая электроны, восстанавливаются. В этом заключается сущность действия гальванического элемента. Металлы, погруженные в растворы электролитов, называются электродами. В гальваническом элементе протекает окислительно-восстановительная реакция, при которой один из электродов окисляется, превращаясь в положительные ионы, которые переходят в раствор. Одновременно положительные ионы, содержащиеся в растворе, восстанавливаются в атомы металла.)
29 (Наиболее просто электролиз протекает в расплаве, так как здесь в процессе электролиза участвуют только ионы электролита. Значительно сложнее протекает процесс электролиза в водном растворе. Дело в том, что вода также является электролитом, хотя и очень слабым. Она диссоциирует на ионы Н+ и ОН-. Таким образом, в водном растворе электролита имеются ионы не только растворенного электролита, но и ионы воды. Какие из ионов будут разряжаться, зависит от того, что представляет собой электролит. Как правилом, можно пользоваться следующими положениями:
- Если положительными ионами электролита являются ионы щелочных или щелочноземельных металлов, у катода будут разряжаться положительные ионы H+:
Значит, у катода будет выделяться водород и будут накапливаться ионы ОН-, которые вместе с содержащимися в растворе ионами металлов образуют щелочь.
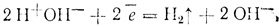
Если отрицательными ионами являются кислотные остатки кислородных кислот, то терять электроны будет вода:
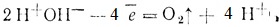
Следовательно, у анода будет выделяться кислород и будут накапливаться ионы Н+, которые вместе с кислотными остатками растворенного электролита образуют кислоту.
Пример 1. Электролиз водного раствора NaCl:
у катода (-): 2 Н+ОН- - 2е = Н2 + 2 ОН-;
у анода (+): 2Cl- - 2e = Cl2↑
Пример 2. Электролиз водного раствора CuSO4:
у катода (-): Cu2+ + 2e = Cu;
у анода (+): 2Н+ ОН- - 4е = O2 + 4Н+.)
30 (Количественные отношения при электролизе установлены законами Фарадея.
Первый закон. Количество вещества, образующееся при электролизе, прямо пропорционально количеству прошедшего через раствор электричества, что в математической форме выражается
m = kQ,
где m - масса продукта электролиза, Q - количество прошедшего через раствор электричества, k - коэффициент пропорциональности.
Так как количество электричества, прошедшего через раствор, равно произведению силы тока (а) на время (сек), то
m = kIt.
Второй закон. При одинаковом количестве пропущенного через раствор электричества количество грамм-эквивалентов продуктов электролиза одинаково. Экспериментально установлено, что для выделения 1 г*экв продукта электролиза требуется пропустить через раствор (округлено) 96 500 к. Это число называется числом Фарадея и обозначается буквой F.
Отсюда следует, что количество грамм-эквивалентов продуктов электролиза (v):
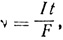
а масса продукта электролиза
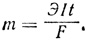
)
31 (См.: А. П. Егоров, А. И. Шершевский и И. В. Шманенков. Общая химическая технология неорганических веществ. М., "Химия", 1964, стр. 64.)
32 (При расчетах, связанных со сложными химическими процессами, количественные отношения веществ, участвующих в них, могут быть найдены по стехиометрическим схемам, которые составляются следующим образом: слева записываются формулы исходных веществ, а справа формулы получающихся веществ. Перед формулами подвигаются коэффициенты таким образом, чтобы количества атомов элементов, содержащихся как в исходных, так и в получающихся веществах, были одинаковыми. Например, вычисление количества серной кислоты по количеству FeS2, являющегося исходным веществом при производстве серной кислоты, производится по стехиометрической схеме: FeS2 → 2 H2SO4.)
33 (В смеси газов давление отдельного газа составляет часть общего давления, соответствующую объемному содержанию этого газа в смеси.)
34 (Расчет производится исходя из того, что предельный углеводород можно рассматривать как вещество, состоящее из n групп СН2 и двух атомов водорода.)
35 (Метакриловую кислоту можно рассматривать как акриловую кислоту, в которой водород звена, связанного с карбоксильной группой, замещен метильной группой.)
36 (Глицеридами называются сложные эфиры глицерина.)
37 Процесс поликонденсации мочевины и формальдегида протекает в три стадии.
- В первой стадии происходит соединение мочевины с формальдегидом с образованием диметилол-мочевины:
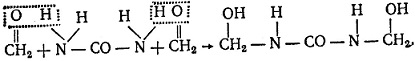
- Вторая стадия происходит при нагревании диметилол-мочевины, в результате чего образуется диметилен-мочевина:
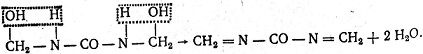
- В третьей стадии идет разрыв двойных связей с образованием активных молекул:
соединением которых образуется трехмерный полимер.
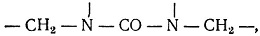
38 (Группа NH2 в аминокислотах может располагаться в разных звеньях кислоты. Это отмечается греческими буквами α, β, γ и т. д.)
39 (Принято степень жесткости воды выражать числом миллиграмм-эквивалентов СаО, содержащихся в 1 л раствора.)
40 (В газовой смеси количество молей компонентов пропорционально объемному составу.)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'