
Глава XIV. Комбинированные задачи
914.1,130 г смеси сульфита натрия и сульфата натрия растворили в воде и прибавили растворы хлорида бария и соляной кислоты в избытке. Выпавший осадок был промыт, высушен, прокален и взвешен. Масса его оказалась равной 1,165 г. Определить:
- что представлял собой выпавший осадок,
- каков процентный состав смеси.
915. На растворение 2,06 г гидроокиси трехвалентного "металла израсходовано 30 см3 1 М раствора H2SO4. Определить атомную массу металла, установить, что это за металл, и вывести формулу гидроокиси.
916. К раствору галогенида одновалентного металла прибавлен раствор нитрата серебра в избытке. Выпал белый, творожистый, нерастворимый в азотной кислоте осадок, масса которого равнялась 0,68 г. Знай, что содержание "лора в галогениде составляло 47,6%, вычислить атомную Кассу металла, молекулярную массу галогенида и вывести его формулу.
917. К раствору, содержавшему хлорид натрия, хлорид магния, хлорид цинка, хлорид меди и хлорид алюминия, прибавили раствор гидроокиси натрия в избытке. Какие вещества содержались в растворе после отделения от него осадка и что представлял собой осадок?
918.1,563 г смеси хлорного железа и хлорида алюминия растворили в воде и прибавили раствор гидроокиси калия в избытке. Выпавший осадок отфильтровали, промыли и прокалили. Масса его оказалась равной 0,640 г. Что представлял собой осадок после прокаливания? Вычислить состав смеси, выразив его в процентах.
919.1,94 г сплава меди с пинком поместили в колбу, содержавшую 50 см3 20-процентной серной кислоты (d = 1,148 г/см3). Колбу закрыли пробкой с газоотводной трубкой и нагревали, пока не прекратилось выделение газа. Объем выделившегося газа был измерен и оказался равным в пересчете на нормальные условия 448 см3. Вычислить количественный состав сплава, выразив его в процентах. Установить, что оказалось в растворе по окончании реакции и в каких количествах.
920. Плотность по водороду смеси азота и кислорода равна 15,2. Вычислить количественный состав смеси, выразив его в процентах.
921. Двуокись азота существует только при температуре выше 140° С, ниже этой температуры газ представляет собой смесь двуокиси азота с четырехокисью азота:
2NO2 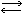 N2O4.
N2O4.
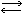 N2O4.
N2O4.Плотность пара этой смеси по водороду равнялась 35. Вычислить, сколько процентов двуокиси азота и четырех-окиси азота содержалось в смеси.
922. Вычислить плотность по водороду смеси, состоящей из 80% окиси углерода и 20% двуокиси углерода.
923.1,19 г сплава алюминия с цинком растворили в 40 см3 25,4-процентной серной кислоты (d = 1,185 г/см3). В результате реакции выделилось 896 см3 водорода (при н. у.). Вычислить:
- сколько процентов алюминия и цинка содержалось в сплаве,
- что оказалось в растворе после реакции и в каких количествах.
924. При взаимодействии 1,458 г хлорида железа с нитратом серебра получилось 3,874 г хлорида серебра. Вычислить состав хлорида железа, выразив его в процентах, и вывести формулу этого соединения.
925. При реакции между 3,59 г окисла свинца и соляной кислотой образовалось 0,54 г воды. Вычислить количественный состав окисла, выразив его в процентах, и вывести его формулу.
926. Вещество состоит из углерода, водорода и хлора. При сжигании некоторого количества этого вещества получено: 448 см3 двуокиси углерода (при н. у.) и 0,18 г воды. Хлор же, содержавшийся во взятом количестве соединения, образовал 8,6 г хлорида серебра. Установить количественный состав этого соединения, выразив его в процентах, и вывести формулу его.
927. Минерал полигалит содержит 28,90 % K2SO4; 19,94% MgSO4; 45,19% CaSO4 и 5,980% H2O. Вычислить, сколько молей каждого из этих соединений содержится в 100 г полигалита, и составить формулу его.
928. Одним из технических способов получения гидроокиси натрия (каустической соды) является ферритный способ. Исходным веществом при этом способе служит безводный карбонат натрия (кальцинированная сода) Na2CO3. Карбонат натрия смешивают с избытком измельченной окиси железа Fe2O3 и прокаливают при температуре выше 1000° С. В результате протекающей реакции образуется феррит натрия Na2O*Fe2O3. Горячей водой феррит натрия разлагается с образованием раствора гидроокиси натрия и нерастворимой окиси железа.
- Составить уравнения протекающих реакций;
- считая, что выход по карбонату натрия составляет 85%, вычислить количество карбоната натрия, расходуемого на получение 1 т 82-процентной гидроокиси натрия.
929. Чтобы определить содержание хлорида калия в одном из образцов сильвинита, было взято 1,219 г этого минерала. Проба была растворена в воде. Раствор отфильтровали, к фильтрату прибавили раствор нитрата серебра в избытке. Выпал осадок, масса которого равнялась 2,267 г. Считая, что во взятой для определения пробе, кроме KCl и NaCl, никаких других растворимых хлоридов не содержалось и что общее содержание хлорида калия и хлорида натрия в сильвините составляло 80%, вычислить, сколько процентов хлорида калия содержалось в сильвините.
930. К смеси солей хлорида натрия, бромида натрия, иодида калия и двуокиси марганца прибавили концентрированную серную кислоту, после чего смесь подогрели. Произошла реакция, в результате которой валентность марганца понизилась с 4 + до 2+. Определить, к какому типу следует отнести происшедшие реакции, какую роль в них играла двуокись марганца. Составить для каждой из них уравнение реакции.
931. Через раствор 2,00 г смеси хлорида калия и иодида калия пропустили хлор в избытке, после чего раствор выпарили, а остаток прокалили. Масса прокаленного остатка оказалась равной 1,78 г. Определить состав смеси, выразив его в процентах.
932. К 2,88 г смеси, содержавшей 41,65% окиси магния, 19,48% окиси кальция и 38,87% окиси цинка, прибавили 100 см3 10-процентного раствора соляной кислоты (d = 1,05 г/см3). Вычислить, что оказалось в растворе после реакции и в каких количествах.
933. Какой объем 5-процентного раствора нитрата серебра (d = 1,04 г/см3) требуется для реакции с хлоридом натрия, содержащимся в 10 см3 7-процентного раствора (d = 1,05 г/см3)?
934. Сколько фтористого кальция и серной кислоты расходуется на получение 1 кг 40-процентной плавиковой кислоты?
935. Для определения содержания двуокиси кремния в материале была взята проба, масса которой равнялась 2,4 г. Ко взятой пробе прибавили плавиковой кислоты в избытке. Смесь нагрели, а затем прокалили. Масса полученного остатка равнялась 1,8 г. Выразить в процентах содержание двуокиси кремния в исследованном материале и, не учитывая потерь, определить, сколько фтористого водорода израсходовано на реакцию.
936. При высокой температуре растворимость хлорида калия значительно выше растворимости хлорида натрия Это дает возможность путем обменной реакции получить из нитрата натрия нитрат калия. В одном опыте это было выполнено следующим образом: в 500 г раствора содержалось хлорида калия из расчета 1 моль хлорида калия на 175 г воды. К кипящему раствору был прибавлен нитрат натрия в эквивалентном количестве. В результате происшедшей реакции выпали кристаллы поваренной соли, которые были отфильтрованы от горячего раствора. Из фильтрата были выделены кристаллы нитрата калия, масса которых оказалась равной 185 г. Вычислить процент выхода соли.
937. Одним из важнейших продуктов химической промышленности является четыреххлористый углерод. Он получается хлорированием метана. Вычислить, не считая производственных потерь, какой объем (при н. у.) природного газа, содержащего 95% метана, требуется для производства 1 т четыреххлористого углерода.
938. Плотность жидкого хлористого водорода 1,194 кг/л. Вычислить:
- объемы хлора и водорода (при н. у.), расходуемые на получение жидкого хлористого водорода, помещающегося в баллоне емкостью 50 л;
- сколько хлористого натрия и воды требуется для получения электролизом вычисленного количества хлора и водорода.
939. Двуокись хлора CO2 применяется в качестве отбеливающего вещества. Белящее свойство ее обусловлено выделением кислорода при взаимодействии с водой:
4ClO2 + 2H2O = 5O2 + 4HCl.
Вычислить:
- массу кислорода, теоретически получаемого из 10 моль двуокиси хлора;
- нормальность раствора HCl по окончании реакции, считая, что объем раствора будет равен 100 л.
940. Через 50 см3 раствора сульфата натрия пропущен хлор в избытке. К этому раствору прибавлен раствор хлорида бария в избытке. Выпало 1,747 г белого осадка. Вычислить молярность и нормальность исходного раствора сульфита натрия.
941. Для реакции с сульфитом натрия потребовалось 50 см3 раствора иода. По окончании реакции к полученному раствору прибавили раствор хлорида бария в избытке. Выпал белый, нерастворимый в кислоте осадок, масса которого равнялась 1,165 г. Вычислить, сколько иода содержалось в 1 л использованного раствора иода.
942. Соляная кислота получалась в лаборатории взаимодействием поваренной соли и серной кислоты. Для реакции взято 800 г NaCl. Выделившийся хлористый водород улавливался водой. Объем полученной соляной кислоты 1 200 см3. Для определения концентрации соляной кислоты взяли 10 см3 ее и разбавили до 100 см3. Из разбавленного раствора отобрали 25 см3 и нейтрализовали 1 н. раствором едкого натра. На нейтрализацию ушло 20 см3 этого раствора.
Вычислить:
- нормальную концентрацию соляной кислоты;
- количество полученного хлористого водорода (в г);
- процент выхода.
943. К 20 см3 0,2 М раствора сульфата, в котором валентность металла выражалась нечетным числом, прибавили раствор хлорида бария в избытке. Выпал белый осадок, масса которого 2,796 г. Определить валентность металла, входившего в состав исходного сульфата, и нормальность исходного раствора.
944.1,8 г сульфата двухвалентного металла растворили в воде. Объем раствора довели до 25 см3. На реакцию с растворенным сульфатом потребовалось 20 см3 0,75 М раствора хлорида бария Вычислить:
- молярность исходного раствора;
- молекулярную массу растворенного сульфата;
- атомную массу металла, входившего в состав сульфата,
- написать формулу сульфата.
945. 70-процентный раствор серной кислоты смешали с 40-процентным раствором азотной кислоты в отношении 3:1. Вычислить концентрации серной и азотной кислот в смеси по отношению к массе смеси.
946. К 2500 кг 90-процентного раствора прибавили 40-процентный раствор, в результате чего концентрация смеси оказалась равной 80%. Вычислить количество прибавленного 40-процентного раствора.
947.0,0948 г соединения, состав которого выражается формулой КЭО4, растворили в воде. К раствору прибавили серной кислоты и иодида калия в избытке. Произошла реакция, и выделилось 0,381 г иода Уравнение реакции:
10KI + 2KЭO4 + 8H2SO4 = 2ЭSO4 + 5I2 + 6K2SO4 + 8H2O.
Определить молекулярную массу вещества, атомную массу неизвестного элемента и найти его место в периодической системе.
948. К 11,16 г 7,5-процентного раствора вещества, состав которого выражался формулой K2Э2O7, прибавили серной кислоты и эквивалентное количество йодистого калия. В результате реакции выделился иод, масса которого равнялась 0,2286 г. Уравнение реакции:
K2Э2O7 + 6KI + 7H2SO4 = Э2(SO4)3 + 4K2SO4 + 3I2 + 7H2O.
Вычислить молекулярную массу вещества, атомную массу неизвестного элемента, найти место этого элемента в периодической системе.
949. Сколько кубических сантиметров 56-процентного раствора H2SO4 (d = 1,46 г/см3) требуется для приготовления 3 л 1 М раствора?
950. Сколько кубических сантиметров 30-процентного раствора HCl (d = 1,15 г/см3) надо прибавить к 500 см3 5-процентного раствора (d = 1,03 г/см3), чтобы получить 10-процентный раствор?
951. Сколько воды надо прибавить к 100 кг 92-процентного раствора H2SO4, чтобы получить 28,5-процентный раствор?
952. Какова концентрация H2SO4 и HNO3 в смеси, если к 200 кг 90-процентного раствора серной кислоты будет прибавлено 50 кг 50-процентного раствора азотной кислоты и 50 кг воды?
953.5000 кг 20-процентного раствора упарили и получили 65-процентный раствор. Потери в производстве составляли 0,2%. Вычислить массу раствора после упаривания и массу растворителя, удаленного при упаривании.
954. После упаривания 9200 кг 56-процентного раствора нитрата аммония получили 5350 кг 96-процентного раствора. Вычислить производственные потери.
955. Один из известняков, применявшихся в производстве соды, имел следующий состав: СаСO3 92%; MgCO3 3%; SiO2 2,5%; Fe2O3 + Al2O3 0,5%; CaSO4 1,5%; влаги 0,5%. Потеря массы при обжиге известняка составляла 38%. Вычислить теоретическую потерю массы и процент выхода продукта.
956. На получение 1 т извести, содержащей 85% СаО, израсходовано 1,7 т известняка, содержавшего 94% СаСO3. Вычислить процент выхода.
957. Для определения временной жесткости воды взята была проба 250 см3 воды. На реакцию потребовалось 25 см3 0,1 н. раствора HCl. Считая, что временная жесткость воды обусловливалась присутствием в воде одного только бикарбоната кальция, вычислить:
- сколько бикарбоната кальция содержалось в 1 л воды;
- степень жесткости анализированной воды39.
958. В заводских условиях нитрат алюминия готовится из гидроокиси алюминия и азотной кислоты. Вычислить, сколько расходуется технической гидроокиси алюминия, содержащей 90% Al(ОН)3 и 98-процентной азотной кислоты на получение 1 т нитрата алюминия, считая выход равным 95%.
959. Исходным материалом для производства нитрата трехвалентного железа Fe(NO3)3*9H2O служат отходы кровельного железа и азотная кислота. Уравнение реакции:
Fe + 4HNO3 = Fe(NO3)3 + 2H2O + NO.
Окислы азота улавливаются и перерабатываются в нитрат натрия. Вычислить:
- сколько кровельного железа, содержащего 95% железа, и 98-процентной азотной кислоты расходуется на получение 1 т кристаллогидрата Fe(NO3)3*9H2O при выходе 90%;
- сколько нитрата натрия может быть получено из улавливаемых окислов азота, считая потери в производстве равными 2%.
960. Азотноводородная смесь состояла из объема азота и 3 объемов водорода. Давление ее было 300 ат. Определить состав и давление смеси после того, как 10% азота соединилось с водородом, а объем и температура смеси приведены были к первоначальным40.
961. Производство мочевины осуществляется синтезом ее из аммиака и двуокиси углерода:
2NH3 + CO2 = CO(NH2)2 + H2O.
Вычислить, сколько надо ввести в производство на 1 т мочевины (по массе и объему при н. у.):
- двуокиси углерода, содержащей 95% CO2,
- аммиака, который берется с избытком в 100%, если выход мочевины будет составлять 70 %.
962. Главная составная часть удобрения кальциевой селитры - нитрат кальция Ca(NO3)2. Эта соль вследствие гигроскопичности способна слеживаться. Для снижения гигроскопичности к ней прибавляют немного аммиачной селитры. Одна из марок кальциевой селитры содержала в качестве добавки 5% NH4NO3. Общее содержание азота в ней составляло 15,25%, Вычислить:
- сколько процентов Ca(NO3)2 содержалось в этом удобрении,
- сколько в нем содержалось влаги и различных примесей (кроме NH4NO3).
963. В одной из марок кальциевой селитры содержание Ca(NO3)2 составляло 79,05%. Нитрат кальция получался поглощением гашеной известью окислов азота. Получающийся в первой стадии нитрат кальция
Са(ОН)2 + NO + NO2 = Ca(NO3)2 + H2O
в дальнейшем окисляется в нитрат.
Вычислить количество гашеной извести, содержащей 8% примесей, и объем (при н. у.) окислов азота, расходуемых на получение 1 т кальциевой селитры.
964. Фосфор в апатитах и фосфоритах содержится главным образом в виде соединения Ca5(PO4)3F.
- Вычислить в процентах содержание P2O5 во фторапатите;
- выразить формулу Ca5(PO4)3F в виде сочетания формул фосфата кальция и фторида кальция;
- составить уравнение реакции взаимодействия серной кислоты с фторапатитом, при которой образуется однозамещенный фосфат кальция.
965. В одном из образцов суперфосфата содержание усвояемого P2O5 составляло 20%. Не считая примесей и величины выхода, вычислить применительно к 1 т суперфосфата:
- количество однозамещенного фосфата кальция, эквивалентное указанному содержанию P2O6 в суперфосфате,
- количество расходуемого фторапатита на получение найденного количества Са(Н2РO4)2.
966. Через раствор поваренной соли пропускали некоторое время постоянный ток. Выделилось 3360 см3 (при н. у.) хлора. Масса исходного раствора была 200 г, а концентрация его 17,55%. Вычислить массу раствора по окончании реакции и установить, что содержалось в нем и в какой концентрации.
967. При сжигании некоторого количества вещества, состоящего из углерода и серы, было получено 336 см3 двуокиси углерода и 672 см3 двуокиси серы (условия одинаковые). Установить количественный состав вещества и вывести его формулу.
968. В состав газовой смеси входила двуокись серы. 800 см3 (при н. у.) этой смеси пропущено через раствор гидроокиси натрия. После окисления образовавшегося сульфита хлором к раствору прибавили в избытке хлорид бария. Выпал осадок, масса которого равнялась 1,75 г. Составить уравнения протекавших реакций и вычислить содержание двуокиси серы в смеси, выразив его в объемных процентах.
969. Газовая смесь состояла из азота, кислорода и двуокиси серы. Смесь пропускалась через раствор иода до обесцвечивания его. Объем пропущенной газовой смеси (при н. у.) равнялся 2,5 л, а масса содержавшегося в растворе иода была 2,032 г. Составить уравнение протекавшей реакции и вычислить содержание двуокиси серы в смеси, выразив его в процентах.
970. При сжигании 100 см3 предельного углеводорода получено 300 см3 двуокиси углерода. Вывести формулу углеводорода и найти молекулярную массу его.
971. При сжигании 156,8 см3 углеводорода получено 627,2 см3 двуокиси углерода (при н. у.) и 0,054 г воды. Вывести формулу этого углеводорода.
972. Газовая смесь состояла из пропана и бутана. При сжигании 100,8 см3 этой смеси получено 336 см3 двуокиси углерода. Вычислить состав смеси.
973. Газовая смесь состоит из окиси углерода, двуокиси углерода и метана. При пропускании 100,8 см3 этой смеси через раствор гидроокиси натрия объем ее уменьшился на 44,8 см3, а на сжигание остатка смеси израсходовано 39,2 см3 кислорода. Вычислить количественный состав смеси, выразив его в процентах.
974. Молекулярная масса одноатомного спирта равна 60. Вывести формулу этого спирта.
975. На нейтрализацию 0,3 г одноосновной органической кислоты предельного ряда израсходовано 25 см3 0,2 н. раствора едкого натра. Вычислить молекулярную массу кислоты и вывести ее формулу.
976. На нейтрализацию 0,63 г двухосновной органической кислоты израсходовано 35 см3 0,4 н. раствора едкого натра. Вычислить молекулярную массу кислоты и установить ее формулу.
977. При хлорировании 112 см3 газообразного углеводорода (при н. у.) получено 0,73 г HCl. Вычислить, сколько атомов водорода заместилось хлором в молекуле углеводорода.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'