
Развитие общей, неорганической и физической химии
Вопросы общей, неорганической и физической химии в Варшавском университете нашли отражение и развитие в работах выдающихся химиков того времени А. Л. Потылицина, И. С. Телетова и В. В. Курилова. Но среди них Алексей Лаврентьевич Потылицин занимает особое место.
Д. И. Менделеев в некрологе писал: "12 марта скончался, а завтра хоронят скромного, даже тихого на вид, но твердого в убеждениях сибиряка А. Л. Потылицина, имя которого, как исследователя химика и как педагога, не должно умереть в русской памяти. Ведь таких людей много гае бывает. Узнал его сперва как студента Петербургского университета и как работника крепкого, вдумчивого, хотя и свободолюбца, какими были все студенты 60-х годов. Таким он и помер. Родину,- науку и правду никогда, даже в минуты юношеского увлечения, он не забывал, свободы желал не для себя, а для трех упомянутых величин, которым он и посвятил свою жизнь... Это был ученый с юности, кажется с 1872 г., когда он стал лаборантом химической лаборатории Петербургского университета. Все его статьи были полны такого химического интереса, что читали их всегда первыми"1.
1 (ЖРФХО, 40, 1149 (1908).)
Родился А. Л. Потылицин 16 марта 1845 г. в Сибири, в г. Красноярске. Первоначальное образование он получил в Иркутском училище Военного ведомства. По. окончании училища его оставляют учителем. Работая учителем, А. Л. Потылицин готовился к экзаменам на аттестат зрелости, лелея мечту об универаитетском образовании. В 1865 г., когда ему было 20 лет, он оставляет учительскую деятельность и едет в Петербург для поступления в высшее учебное заведение. В августе того же года А. Л. Потылицин успешно сдает экзамены на аттестат зрелости при Ларинской гимназии, что дало ему право поступить в Медико-Хирургическую академию. Однако занятия в академии ему не пришлись по нраву, и он покидает ее. Юношу привлекает удивительный по составу преподавателей физико-математический факультет Петербургского университета, где в это время работали Д. И. Менделеев, А. М. Бутлеров и Н. А. Меншуткин - светочи химии, и он переходит в университет. Лекции Д. И. Менделеева окончательно определили судьбу и направление дальнейшей деятельности А. Л. Потылицина. В 1872 г. он заканчивает университет и там же продолжает исследовательскую работу над темой "Вытеснение окисей металлов подгруппы магния", которую он начал еще студентом.

А. Л. Потылицин
В лаборатории Д. И. Менделеева Алексей Лаврентьевич изучает реакции взаимного вытеснения галоидов. Эти исследования имели целью проверить положения, высказанные Н. Н. Бекетовым о наибольшей устойчивости химических соединений. Изучение реакций взаимного вытеснения галоидов - это первые работы, проведенные в расплавленных средах, т. е. в отсутствии растворителя.
В сентябре 1873 г. А. Л. Потылицин переходит лаборантом в лабораторию Н. А. Меншуткин а, продолжая и здесь ранее начатые исследования. Изучение реакций взаимного вытеснения галоидов и реакций разложения хлоратов, проведенных с исключительной тщательностью, окончательно убедили его в ограничениях "правила наибольшей работы", которое было выдвинуто знаменитым французским химиком Бертло. Согласно этому правилу, всякое химическое превращение, совершающееся, без вмешательства посторонней энергии, стремится к произведению тела или системы тел, которые выделяют наибольшее количество тепла. А. Л. Потылицын экспериментально доказал ограниченность этого правила. Исследуя ряд эндотермических реакций, он показал, что они протекают сравнительно легко. Он изучил реакции вытеснения хлора из хлористых металлов бромом в отсутствии воды при 250-450°; вытеснения кислородом галоидов из галогенидов; реакцию взаимодействия между газообразным хлористым водородом и бромистыми металлами в отсутствии воды; реакции взаимодействия между водородом и галоидными соединениями свинца, кадмия и серебра; действие хлористого водорода и растворов хлоридов на свежеосажденное галоидное серебро и др. Вместе с тем им установлено, что реакция вытеснения брома хлором из бромистых солей относится к экзотермическим реакциям и, следовательно, согласно правилу Бертло, должна протекать легко. В действительности же в безводной среде она протекает весьма трудно. Так, в системе 2NaBr+Cl2 при 20° за 120 часов было вытеснено всего 4,9% брома, участвовавшего в реакции обмена. Аналогичные результаты были получены при изучении реакций с бромистым калием. А. Л. Потылицин нашел также, что взаимодействие между бромистым барием и хлором имеет место только при 100°.
Исключение было замечено при изучении реакции между бромидом серебра и хлором; в этом случае хлор вытеснил значительные количества брома - 75,37%. На примерах рассмотренных реакций А. Л. Потылициным экспериментально было доказано, что правило Бертло не является общим, а имеет большое число исключений и является верным лишь при температуре абсолютного нуля.
В работах "О вытеснении хлора бромом из хлористых металлов" и "Вытеснение брома хлором из бромистых металлов в отсутствии растворителей"1, было продолжено изучение направления реакций в зависимости от атомных весов реагирующих элементов. Вопросу влияния массы на ход реакции замещения посвящены и другие работы: "О взаимном вытеснении галоидов в зависимости от масс" и "О влиянии масс при взаимном замещении галоидов"2. Исследованиями было установлено, что количество хлора, вытесненного бромом из хлористых металлов, возрастает с увеличением атомного веса металла. Так, в ряду щелочных металлов оно увеличивается в такой последовательности:
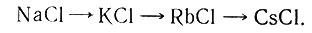
1 (А. Л. Потылицин. ЖРФХО, 6, 173 (1874); ЖРФХО, 7, 273 (1875))
2 (А. Л. Потылицин. ЖРФХО, 14, 82 (1882).)
Количественная зависимость вытесняемого элемента от величины атомного веса реагента была также подтверждена автором в работе "О вытеснении галоидов кислородом".
Изучая взаимное вытеснение галогенов друг другом из солей кислородных кислот, А. Л. Потылицин нашел, что количество вытесняемого галогена возрастает с увеличением атомного веса металла, причем во всех случаях реакция идет по уравнению типа
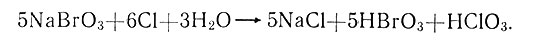
Полученный обширный экспериментальный материал о действии хлора, брома и йода на соли галогенкислородных кислот при разном сочетании пар галогенов дал автору полное основание заключить, что по сродству их к кислороду они должны быть расположены в такой последовательности: йод, хлор, бром.
В 1876 г. А. Л. Потылицин по состоянию здоровья вынужден был оставить университет и выехать на юг Франции, в Канны. Здесь после прохождения курса лечения его здоровье несколько улучшилось, и он вскоре переезжает в Монпелье для занятий научно-исследовательской работой и повышения научной квалификации. Однако после слушания лекций Д. И. Менделеева, А. М. Бутлерова и Н. А. Меншуткина А. Л. Потылицина не могли удовлетворить лекции профессоров Монпелье; он едет в Париж к Вюрцу. Но постановка научно-исследовательской работы и в лабораториях знаменитого французского химика Вюрца не устраивает Потылицина, и в конце лета 1878 г. он возвращается на Родину. Пребывание на Западе и знакомство с постановкой научной работы там еще больше укрепляет в нем уверенность в своих силах. По возвращении из-за границы он сразу же приступает к педагогической и научно-исследовательской работе. Наряду с занятиями в университете он читает лекции по химии в Павловском военном училище. Нужно заметить, что лед а готическая деятельность нравилась ему и спорилась у него. Алексей Лаврентьевич был замечательным педагогом. Он издал для военных училищ прекрасный учебник "Начальный курс химии", получивший тогда высокую оценку и выдержавший восемь изданий. Научно-исследовательская работа А. Л. Потылицина шла также успешно. Это способствовало популяризации его, как выдающегося химика, занявшего видное место в русской "химической дружине".
В 1879 г. было опубликовано его сообщение о результатах исследований вытеснения галоидов кислородом1. В этой работе А. Л. Потылицин показал, что при взаимодействии галогенидов металлов с кислородом вытеснение происходит с различной скоростью. Так, из хлоридов лития, стронция, бария и бромидов натрия и калия при температуре начала красного каления в течение одного часа струею кислорода вытесняются лишь следы галоидов. В ряду хлоридов кальция, свинца и бромидов натрия, кальция, свинца реакция идет значительно быстрее и особенно с солями кальция. В случаях же пропускания кислорода над бромистым кальцием в течение нескольких минут при 300° вытеснение идет весьма заметно.
1 (А. Л. Потылицин. ЖРФХО, 11, 87 (1879).)
Вскоре А. Л. Потылицин на страницах журнала РФХО помещает предварительное сообщение "О действии сухого водорода на безводные соли различных металлов"1, а в декабре 1879 г. выступает на съезде естествоиспытателей со специальным сообщением "О действии водорода на галоидное серебро и о правиле наибольшей работы"2. Названное сообщение вызвало у участников съезда большой интерес. По его докладу выступили Г. Г. Густавсон, Д. И. Менделеев и др.
1 (А. Л. Потылицин. ЖРФХО, 11, 324 (1879).)
2 (А. Л. Потылицин. ЖРФХО, 12, 7 (1879).)
Эти работы ставили целью выяснить действие сухого водорода на галогениды металлов первой и второй групп периодической системы и свинца. Было показано, что хлориды и бромиды свинца и кадмия легко восстанавливаются еще до температуры их плавления; особенно легко идет реакция с бромидом кадмия, при этом выделяющийся кадмий образует металлическое зеркало. Было также установлено, что серебро из солей вытесняется водородом независимо от количества выделяющегося тепла.
Заслуживает внимания работа А. Л. Потылицина "О двойных разложениях в отсутствии воды"1, посвященная изучению реакции взаимодействия между газообразным хлористым водородом и фторидами металлов. Оказалось, что и эта реакция противоречит правилу наибольшей работы Бертло, так как идет самопроизвольно при обыкновенной температуре, но сопровождается поглощением тепла.
1 (А. Л. Потылицин. ЖРФХО, 12, 184 (1879).)
Как обобщение термохимических исследований А. Л. Потылицина явилась его магистерская диссертация "О способах измерения химического сродства", которую он успешно защитил в 1880 г. в заседании Ученого совета С.-Петербургского университета. В этом труде подробно рассмотрено учение о сродстве и способах его измерения и дана рекомендация относительно измерения химического сродства. "Сродство,- пишет автор,- должно быть измерено количествами тел, которыми определяется равновесие двух противоположных реакций: АВ + СД 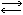 АС + ВД. Теплота, выделяемая при действии тел друг на друга, взятык в сравнимых состояниях, не измеряет полной работы сродства".
АС + ВД. Теплота, выделяемая при действии тел друг на друга, взятык в сравнимых состояниях, не измеряет полной работы сродства".
В 1880 г. А. Л. Потылицин совершает с Д. И. Менделеевым поездку на нефтяные месторождения Крыма и Кавказа. А. Л. Потылицин настолько заинтересовался природой нефти и нефтяных вод, что целиком перешел на разработку указанной тематики и дважды (в 1884 и 1891 гг.) уже самостоятельно совершил аналогичные поездки.
В 1881 г. А. Л. Потылицина назначают профессором Института сельского хозяйства и лесоводства в Ново-Александрии, где он много внимания уделяет улучшению постановки преподавания химии. В том же году выходит его работа "О скоростях химических реакций и об условиях перехода химической энергии в теплоту"1. В этом труде рассматриваются вопросы взаимодействия между хлористым серебром и бромистыми металлами. Автор экспериментально обосновывает зависимость скоростей реакций между хлористым серебром и бромистыми металлами от атомного веса и положения элемента в периодической системе.
2 (А. Л. Потылицин. ЖРФХО, 13, 4 (1881).)
А. Л. Потылицин приходит к выводу, что:
- Скорость реакций для солей металлов первой группы больше, чем для солей металлов второй группы.
- Для бромистых металлов второй группы четных и нечетных рядов скорости образования бромистого серебра различны: для первых они возрастают, для вторых - убывают.
В работах о скоростях реакций и о законе распределения и о законах двойных разложений1 автор разбирает вопрос о влиянии температуры на ход двойных разложений. Было показано, что при различных температурах частицы реагирующих веществ обладают различной кинетической энергией и что кинетическая энергия стремится произвести работу сродства. "Внешняя энергия,- пишет он,- стремится к превращению во внутреннюю, производя работу сродства".
2 (А. Л. Потылицин. ЖРФХО, 13, 183, 289, 215 (1881).)
При малом напряжении внешней энергии, утверждает автор, преобладают реакции с выделением тепла, а при отсутствии этой энергии (абсолютный нуль) образование эндотермических веществ вообще невозможно. При значительном напряжении внешней энергии будет иметь место образование эндотермических веществ, а при очень большом напряжении внешней энергии - полное разложение веществ на элементы. В природе оба превращения (химической энергии в теплоту и обратно) идут одновременно, что и обусловливает "то состояние подвижного равновесия, которое всюду наблюдается в органической и неорганической природе". "Вот этот-то механизм,- говорит далее Потылицин,- опирающийся на закон распределения, и управляет в природе превращением внешней кинетической энергии в потенциальную, на него опирается существование и развитие растительного и животного царств и множество химических процессов в неорганической и органической природе земного шара". Примечателен тот факт, что это впервые было высказано А. Л. Потылициным в 1880 г., т. е. за три года до появления работы Вант-Гоффа, в которой трактуется максимальная работа как мера химического сродства (1883 г.). Поэтому, говоря о законе Вант-Гоффа, мы должны знать, что впервые, на три года раньше, аналогичные мысли были высказаны А. Л. Потылициным.
В 1882 г. Алексей Лаврентьевич переходит в Варшавский университет, где успешно продолжает свою научную деятельность. Здесь как обобщение его теоретических исследований явилась докторская диссертация "О значении теплоты образования солей - при реакциях двойных разложений", которая успешно была защищена в С.-Петербургском университете в 1886 г. В этом же году он был назначен ординарным профессором Варшавского университета.
В докторской диссертации А. Л. Потылицин дает обстоятельную трактовку вопроса о скоростях реакций образования солей посредством двойных разложений. Теоретические выводы он обосновывает экспериментальными исследованиями скоростей образования бромистого серебра в системах: AgCl + MBr (M = Li, Na, K, Mg, Ca, Sr, Ba, Zn и Cd) и AgJ в системах: AgCl + KJ; AgBr + KJ.
Ученый провел четыре серии опытов с целью определения:
- скорости образования бромистого серебра при действии на свежеосажденное хлористое серебро растворов бромистых металлов;
- скорости образования бромистого серебра действием на хлористое серебро бромидами металлов, но при встряхивании;
- действия на растворы азотнокислого серебра смеси хлористых и бромистых металлов;
- превращения бромистого серебра в хлористое серебро при действии хлористых металлов.
Было найдено следующее соотношение между скоростью реакций и теплотой образования: 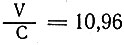 , где V - скорость перехода серебра из хлористого в бромистое, выраженная в процентах; С - теплота образования.
, где V - скорость перехода серебра из хлористого в бромистое, выраженная в процентах; С - теплота образования.
В "Заметке по вопросу о соотношении между начальными скоростями и теплотой образования солей"1 он указывает, что это соотношение сохраняется и для солей двухатомных металлов, в частности для щелочноземельных металлов оно принимает вид: 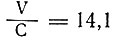 .
.
1 (А. Л. Потылицин. ЖРФХО, 17, 211 (1885).)
Наиболее плодотворными в научной деятельности А. Л. Потылицина нужно считать годы пребывания в Варшавском университете. Именно в этот период им были произведены наиболее результативные исследования.
В работе "О скоростях и продуктах разложения солей галоид кислородных кислот при нагревании"1 еще раз была подтверждена ошибочность уже проводившихся выше взглядов Бертло. По правилу наибольшей работы, реакции, сопровождающиеся выделением тепла, должны идти легко и так, чтобы в результате была получена система тел, образование которой сопровождается наибольшим выделением тепла. С этой точки зрения. МСlO3 = МСl + (3O). Однако исследованием реакций разложения солей бария, стронция, кальция, лития хлорноватой кислоты и калия, стронция, бария бромноватой кислоты А. Л. Потылицин установил, что разложение перхлоратов происходит по уравнению
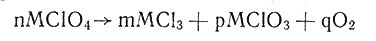
1 (А. Л. Потылицин. ЖРФХО, 19, 339 (1886).)
Количество получающегося перхлората различно в различные стадии разложения. Выход перхлоратов зависит не только от времени, но и от температуры и металла, входящего в состав соли. Образующийся перхлорат в свою очередь разлагается по уравнению
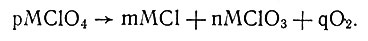
Направление реакций разложенаия перхлоратов, по трактовке А. Л. Потылицина, обусловливается подвижным равновесием между двумя процессами:
- разложением перхлоратов с образованием хлоратов;
- разложением хлоратов с образованием перхлоратов.
Аналогично происходит процесс распада и броматов с той лишь разницей, что в случаях хлоратов и перхлоратов при изменении скорости реакции имеется один максимум,, тогда как для броматов их - два. Автор объясняет это возможностью изомерного превращения броматов.
Все это позволило А. Л. Потылицину прийти к выводу, что в случаях, когда реакции не протекают в соответствии с правилом наибольшей работы, то их направление определяется законом обменных разложений и, прежде всего, законом распределения Бертло. "Эти реакции,- говорит А. Л. Потылицин,- объяснимы только на основании правила подвижного равновесия, правило это можно выразить так: при всяком химическом превращении равновесие системы тел зависит от величины их атомных весов, относительных количеств (масс) и запаса наличной энергии - внутренней и внешней"1.
1 (А. Л. Потылицин. ЖРФХО, 19, 345 (1886).)
Заслуживают упоминания работы А. Л. Потылицина в области гидратов и пересыщенных растворов. Он был горячим сторонником химической теории растворов Д. И. Менделеева, поэтому вопрос о растворах связывал с вопросом об определенных гидратах растворимого вещества. В работе "О гидратах хлористого кобальта"1 он устанавливает взаимосвязь между изменениями цвета растворов этого вещества и изменениями состава определенных гидратов хлористого кобальта. Так, переход гидрата СоСl2×6Н2O красного цвета в кристаллические гидраты хлористого кобальта розовый с фиолетовым отливом и темно-фиолетовый обусловлены изменением состава кристаллогидратов хлорида кобальта, а именно, образованием СоСl2×2Н2O и СоСl2×Н2O.
1 (А. Л. Потылицин. ЖРФХО, 16, 544 (1884).)
Большой интерес представляет его работа "О некоторых свойствах хлорнонатриевой соли и о пересыщенных растворах"1, имеющая как практическое, так и теоретическое значение. В ней описывается интересный случай, когда кристаллогидрат состава NaClO4×H2O выветривается при нагревании до 54° даже в присутствии воды. Выше 54° из растворов выделяется безводная соль, которая при более низкой температуре переходит в одноводный гидрат. Здесь же автор высказывает свою оригинальную теорию пересыщенных растворов, согласующуюся со многими опытными данными. Исследованию природы пересыщенных растворов посвящены также его работы "Об условиях образования -пересыщенных растворов"2 и "К вопросу о пересыщенных растворах"3.
1 (А. Л. Потылицин. ЖРФХО, 21, 258 (1888).)
2 (А. Л. Потылицин. ЖРФХО, 25, 73 (1893).)
3 (А. Л. Потылицин. ЖРФХО, 25, 201 (1893).)
Автор утверждает, что образование пересыщенных растворов зависит от природы растворяемого вещества. Так, вещества, способные давать несколько изомеров или соединений различного состава, имеют склонность к образованию пересыщенных растворов. Как на особое свойство пересыщенных растворов, он указывает на их способность выделять низшие гидраты и даже безводные соли, которые наряду с гидратами содержатся в пересыщенных растворах. Ценность этой теории заключается в том, что в ней не проводится резкой границы между обычными и пересыщенными растворами, а, наоборот, устанавливается генетическая связь и общность их природы. Дальнейшее развитие теории пересыщенных растворов дается в работе "О хлорноватостронцевой соли и скоростях ее разложения при нагревании"1, опубликованной в 1889 г. Известно было, что хлорат стронция образует пересыщенные растворы. А. Л. Потылицин, руководствуясь своей теорией, предсказывает наличие кристаллогидратов и других кристаллических видоизменений для хлората стронция, что впоследствии было подтверждено получением трех кристаллических видоизменений этой соли и выделением кристаллогидрата состава Sr(СlO3)2×3Н2O.
1 (А. Л. Потылицин. ЖРФХО, 21, 451 (1888).)
А. Л. Потылицин был целеустремленным исследователем и отличался пытливым умом. Эти качества помогли ему разрешить вопросы из малоизведанных областей химии. Представляет несомненный интерес его исследование о пересыщенных растворах гипса, о строении его гидратов и о процессе схватывания гипса. В работах "К вопросу о пересыщенных растворах"1 и "О полуводном гидрате гипса"2 автор показал, что гипс легко теряет воду и переходит в полуводный гидрат 2CaSO4×Н2O. В пересыщенных растворах гипса содержится главным образом кристаллогидрат этого состава, обусловливающий перенасыщенность раствора. Определив теплоты образования гидратов гипса, Потылицин нашел, что превращение полуводного гидрата в двухводный сопровождается незначительным тепловым эффектом, поэтому переход полуводного гидрата в двухводный происходит медленно. Следствием этого является и тот факт, что пересыщенный раствор, несмотря на наличие кристаллов соли, медленно выделяет двухводный гидрат. Взгляды автора по вопросу о "гидратации гипса и данные о те плотах образования гидратов гипса изложены в работе "О теплоте образования гидратов сернокальциевой соли"3.
1 (А. Л. Потылицин. ЖРФХО, 25, 201 (1893).)
2 (А. Л. Потылицин. ЖРФХО, 25, 207 (1893).)
3 (А. Л. Потылицин. ЖРФХО, 26, 129 (1894).)
Изучению свойств гипса посвящена и его работа "О растворимости безводного гипса"1.
1 (А. Л. Потылицин. ЖРФХО, 26, 170 (1894).)
Закономерности растворения гипса ученый объясняет существованием у безводного гипса α- и β-модификаций, отличающихся способностью присоединять воду: α-модификация присоединяет ее быстро и удерживает прочно, β-форма - хотя и быстро, но удерживает ее непрочно. Гипс α-формы получается высушиванием гипса при нижних температурах, β-гипс - при 350° и выше; ниже 350° образуется смесь обоих видоизменений. Исследованиям гипса в дальнейшем была посвящена серия работ, среди которых представляют практический и теоретический интерес работы по изучению строения гипса и его гидратов и по выяснению процесса схватывания гипса1.
1 (А. Л. Потылицин. ЖРФХО, 26, 221 (1894).)
Вопрос о строении гипса и его гидратов был сложным и запутанным. Успешно его разрешил А. Л. Потылицин в работе "О строении сернокальциевой соли и ее гидратов"1, в которой он рассматривает гипс как соль дигидрата серной кислоты H2SO4×2H2O. Полуводный гидрат Ca2S2O8×H2O, по Потылицину, имеет следующее строение:
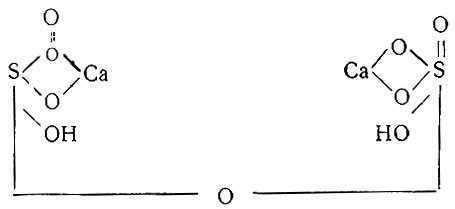
1 (А. Л. Потылицин. ЖРФХО, 27, 324 (1895).)
Предложенная формула полуводного гидрата гипса хорошо объясняет тот факт, что из гипса легко выделяется только 3/4 кристаллизационной воды. Так как четвертая часть воды находится в ином положении, чем три другие, она труднее выделяется из соли. При 120° гипс отдает последнюю частицу воды, и происходит изменение его строения:
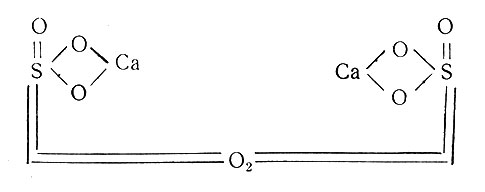
Эта модификация гипса при повышении температуры переходит в β-гипс путем димеризации α-частиц. Димеризация происходит за счет связи атомов кислорода или кальция, поэтому автор полагает, что строение β-гипса может быть двояким:
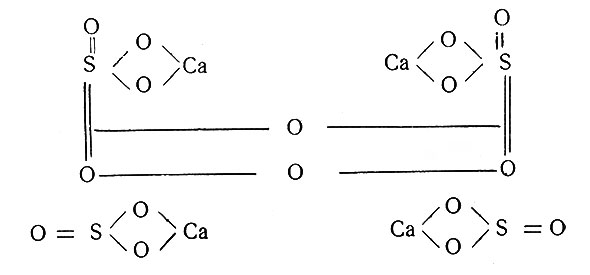
или
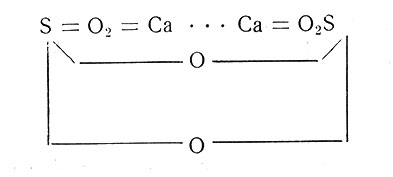
Исследования свойств безводных модификаций гипса и его гидратов привели А. Л. Потылицина к решению важного в практическом отношении вопроса о затвердевании гипса. Причины и условия затвердевания гипса издавна занимали исследователей. Лавуазье в 1765 г. впервые научно объяснил затвердевание гипса поглощением воды. Количественные же исследования никем не проводились.
В работе "О причине и условиях затвердевания безводного гипса"1 А. Л. Потылицин приводит теорию и механизм "схватывания" гипса. Автор считает, что при смешении жженого гипса с водой α-модификация переходит в полуводный гидрат, который, растворяясь, образует пересыщенный раствор. Превращение полуводного гидрата в двухводный и происходящее при этом нагревание обусловливают выделение из раствора кристаллов CaSO4×2Н2O, которые распределяются между крупинками безводной и полуводной соли, что приводит к схватыванию гипса после выделения CaSO4×2Н2O. При этом концентрация раствора уменьшается, и в нем могут растворяться новые количества полуводного гидрата гипса, в образовании которого участвует уже β-модификация гипса. Повторение этого явления - суть процесса затвердевания гипса.
1 (А. Л. Потылицин. ЖРФХО, 26, 170 (1894).)
Схватывание и свойства затвердевшей массы зависят от соотношений количеств входящих в жженый гипс видоизменений. Разработка А. Л. Потылициным вопроса схватывания гипса наряду с теоретическим имела большое практическое значение, так как был положен конец разногласиям в этом деле.
Экспериментальный материал по нефтяным водам, собранный А. Л. Потылициным во время поездок на Кавказ, привел его к разработке классификации вод. Нефтяные воды он делит на две группы: кислые и щелочные. Первая находится в восточной, прикаспийской части нефтяных месторождений. Она содержит исключительно хлориды металлов, главным образом хлориды натрия, кальция и магния. Вторая группа - щелочные воды - находится в северо-западной и южной частях кавказских месторождений нефти Тамань и Апшеронский полуостров). В основном они содержат карбонаты и галогениды металлов, а также большие количества йода. Анализ воды из озера Кудако (Тамань) показал, что по содержанию йода и минерализации она не уступает лучшим йодным источникам, и ученый рекомендовал ее для лечебных целей.
А. Л. Потылицину удалось получить ряд ценных данных, касающихся генезиса нефтяных месторождений Кавказа и Крыма. Он отмечает, что в Крымском районе нефть редко сопровождается водой. Только около Ченчелека вода, солено-щелочного характера с содержанием йода, сопутствовала нефти. Крымские месторождения, по его утверждениям, имеют ту особенность, что содержат много нефтяного газа1.
1 (А. Л. Потылицин. ЖРФХО, 27, 289 (1895); "Варшавские университетские известия", № 1, 1-4 (1885).)
Продуманная и целенаправленная деятельность А. Л. Потылицина особенно была плодотворна в варшавские годы. В Варшавском университете юн пробыл до 1895 г.
А. Л. Потылицин вел и педагогическую работу. Он был блестящим лектором. Его лекции были настолько увлекательными, что часто сопровождались громом аплодисментов. В сентябре 1895 г. его назначили директором Ново-Александрийского института. Руководство хозяйственной деятельностью отвлекало его от научных исследований и очень тяготило.
В 1899 г. Алексея Лаврентьевича постигло горе: умерла дочь, а затем и жена. Здоровье А. Л. Потылицина было резко подорвано. 12 марта он уходит в отставку.
Жизнь Алексея Лаврентьевича - замечательного химика и патриота, отдавшего все служению науке и Родине, оборвалась 25 февраля 1905 т. "Жизнь и научная деятельность Алексея Лаврентьевича заслуживает долгой и доброй памяти. Вышедший из народа, он чутьем познал, что знание - это сила. К этому знанию он стремился всю жизнь и тогда, когда выходил из далекой Сибири, и тогда, когда он сам сделался ученым и профессором. Своим ученикам он завещал черпать в знании силу. Благодаря этой силе он сам поддерживал свой слабый организм, свою бодрость духа и свежесть своей химической мысли"1.
1 (ЖРФХО, 40, 1149 (1908).)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'