
Физико-химический анализ на кафедре неорганической химии
Первые работы по физико -химическому анализу на кафедре неорганической химии начаты по инициативе В. В. Курилова еще в Варшавском университете. В числе его учеников, кроме упоминавшихся Д. Е. Дионисьева и Н. Н. Стасевича, был А. П. Попов.
Алексей Петрович Попов родился в 1882 г. в Ростовской области в семье казана. В 1912 г. он окончил естественное отделение физико-математического факультета Варшавского университета по специальности химии и был оставлен для подготовки к профессорскому званию. Будущий ученый получил научную командировку в Гессен, в Германию, в лабораторию профессора Фишера, где проходил практику по электросинтезу и электроанализу. В 1915 г. вместе с университетом он переехал в Ростов.
Еще в Варшаве молодой ученый выполнил первое исследование по физико-химическому анализу "Аммиакаты галоидных солей никеля"1, В 1919 г. он сдал магистерские экзамены и начал работать ассистентом у профессора К. В. Харичкова.
1 (А. П. Попов. Варшавские университетские известия, кн. 6, 1915.)

А. П. Попов
После смерти профессора А. П. Попов принял обязанности заведующего кафедрой технической химии. Здесь он провел большое количество аналитических исследований углей, жидкого топливу, пищевых продуктов, природного газа и минеральных вод для различных организаций г. Ростова и Ростовской области.
В работе "Газометрическое определение водорода путем поглощения золями палладия и платины"1, автор рекомендует удобный метод количественного определения водорода.
1 (А. П. Попов. Изв. Донского ун-та, кн. 1, 1921.)
В 1911 г. был разработан метод Пааля и Гартмана, предложивших в качестве поглотителя водорода смесь пикрата натрия и палладиевого золя.
А. П. Поповым было установлено, что поглощение водорода смесью золей платины и палладия протекает быстрее и полнее, чем каждым поглотителем в отдельности. Им доказано, что палладий - один из лучших адсорбентов водорода - проявляет слабое каталитическое действие, тогда как платина, будучи очень хорошим катализатором, является сравнительно слабым адсорбентом, что с введением в адсорбционную смесь палладия происходит полная диссоциация его гидрида, частично образующегося при поглощении им водорода. При распаде гидрида образуется водород, который в момент выделения служит восстановителем пикрата и других соединений. Способ определения водорода смесью золей палладия и платины, разработанный А. П. Поповым, имеет большое преимущество по сравнению с дробными сжиганиями по Винклеру и эвдиометрическим методом по Генкелю - поглощением губчатым палладием.
А. П. Попов и В. А. Карницкий в лаборатории технической химии произвели анализ газа, собранного на даче Костырева, расположенной на берегу р. Сочи, вблизи моря, и установили большое содержание в этом газе азота (до 39%), что указывало на возможность присутствия инертных газов группы аргона. По горючим компонентам данный газ отличается от найденного в окрестностях г. Сочи, анализ которого был произведен в 1917 г. Карстенсом. Можно сказать, что этими анализами было положено начало исследований кубанских и ставропольских месторождений газа.
А. П. Попов вел большую педагогическую работу, систематически читал курсы химической технологии воды и топлива, технической химии и руководил практикумом.
Будучи председателем аналитической комиссии при университете, он поддерживал постоянную связь с промышленными предприятиями г. Ростова и области и принимал активное участие в работе общества естествоиспытателей.
Научную, педагогическую и общественную деятельность А. П. Попов продолжал на химическом факультете вплоть до смерти, постигшей его в 1934 г.
Весьма успешно применил методы физико-химического анализа для решения прикладных задач С. А. Дуров, приглашенный на кафедру общей и неорганической химии в 1932 г.
С. А. Дуров окончил реальное училище, а затем Рижский политехнический институт. Еще ,студентом он увлекся химией. Большое влияние на формирование его как химика оказали академик П. И. Валиден, М. Центнершвер, Шиманский и другие, работавшие в Рижском политехническом институте.
С особой теплотой вспоминает Святослав Алексеевич академика П. И. Вальдена, чьи лекции так нравились студентам.
В институте С. А. Дуров под руководством М. Центнершвера выполнил дипломную работу по растворимости металлов, а под руководством Брицке - дипломный проект доменного цеха.
Окончив с отличием в 1915 г. институт, С. А. Дуров работает лаборантом в лаборатории Владикавказской железной дороги. Здесь практически и началась его научная деятельность. Он изучал все методы испытаний топлива, металлов, воды и красок; исследовал воды, которыми питались паровозы Северо-Кавказской железной дороги, разрабатывал способы их очистки, умягчения и т. д.
В университете С. А. Дуров продолжает работы по вспениванию и выбросу котлоных вод. С 1936 г. он принимает заведование кафедрой общей и неорганической химии и одновременно читает курсы неорганической, технической химии и физико-химического анализа, не прекращая свои исследования в области котловой химии, гидрохимии и коррозии металлов от действия щелочных артезианских вод.
В работе "Разъедание медных частей паровых котлов щелочными артезианскими водами"1 С. А. Дуров и Г. М. Искидаров доказывают, что действие артезианских вод на медные части паровых котлов является частным случаем влияния котельных воя на котел и его части.
1 (С. А. Дуров, Г. М. Искидаров. Разъедание медных частей паровых котлов артезианскими щелочными водами. М., Изд-во "Транспортник", 1932.)
Следует отметить, что артезианские воды на обширном пространстве нашей Родины характерны для многих мест. Разработкой вопроса о действии этих вод на стенки паровых котлов впервые, можно сказать, занялись С. А. Дуров и инженер Г. М. Искидаров. Ими было показано, что едкий натр в присутствии кислорода оказывает большее разъедающее действие на медные части, чем карбонат, бикарбонат и хлорид натрия, но последний в присутствии кислорода является наиболее сильным агрессором. Меньшее разъедающее действие оказывает сульфат натрия. Степень коррозии зависим от местоположения частей котла и образования на них накипи. Эти исследования, по существу, продолжили работы профессора С. П. В о лог дина.

С. Л. Дуров
Большое внимание С. А. Дуров уделил разработке методов очистки питьевой воды от сероводорода. Эти исследования им были оформлены в кандидатскую диссертацию "Очистка питьевой воды от сероводорода",1 защищенную в 1937 г. в Новочеркасском политехническом институте. Автором было найдено, что самым рентабельных способом очистки воды от сероводорода является аэрация ее разбрызгиванием (фонтанированием) или аэрация се в градирнях.
1 (С. А. Дуров. Очистка питьевой воды от сероводорода. Изд. АЧНИКХ, 1935.)
Удаление сероводорода из воды идет без побочных реакций. После аэрации она становится прозрачной, а сероводород полностью удаляется. Исследования автора послужили основой сооружения установки по обессериванию воды в г. Ейске.

Лаборатория физико-химического анализа кафедры общей и неорганической химии
В 1942 г. С. А. Дуровым в Ростовском университете была защищена докторская диссертация на тему "Вспенивание и выброс котловой воды", несколько дополненная монографией "Физико-химические основы пенистого переброса котловой воды", изданной Академией наук СССР. Автор обобщил данные многолетних экспериментальных доследований по гидрохимии котловых вод и дал физико-химическое обоснование процессов вспенивания и переброса котловой воды. Он впервые установил связь между явлением вспенивания и местными особенностями тех вод, которыми питают котлы. Было проделано более 130 анализов осадков котловых вод и сделан ряд интересных теоретических и практических выводов.
По объяснениям ученого, резкое вспенивание котловых вод и их выброс характерны для тех районов, где наблюдается смешивание воды трех типов: жестких с высоким количественным соотношением ионов магния и кальция; щелочных, содержащих бикарбонат натрия, и сернистых, содержащих растворимые сульфиды и сероводород.
Сопоставление данных анализов, обобщенных на диаграмме Гиббса-Розебома, позволило разграничить твердые накипи с высоким содержанием гипса, карбоната кальция и илистые осадки, содержащие окись магния в виде основного карбоната магния состава 5MgO×2СО2×3Н2О. Было также показано, что сильное вспенивание не определяется большим количеством образующихся осадков. Оно, как и переброс, происходит в результате химического взаимодействия осадка и электролита.
Взятые раздельно, осадки и электролиты вспенивания не вызывают. Оно является следствием коллоидного состояния системы, которое, в свою очередь, зависит от концентрации электролита. С. А. Дуров нашел вещества пеногасители, применение которых уменьшает пенообразование. Хорошими пеногасителями оказались крахмал, легко адсорбирующийся на поверхности железа, и щавелевая кислота, образующая поверхностное соединение с ним.
Автор установил связь между процессом пенистого переброса котловой воды и извержением гейзеров. Очень интересно, что полученная кривая пенистого переброса имеет типичную S-образную форму.
По утверждениям С. А. Дурова, пенистый переброс может быть объяснен действием двух факторов: напряжения ионно-дипольного поля, которое пропорционально концентрации соли, взятой в степени 3/2, и наиболее благоприятного распределения коллоидных частиц оптимальный степени дисперсности. Величина переброса равна произведению численных выражений этих факторов.
Ученый разработал классификацию природных вод и метод графического выражения их анализов. Этот вопрос обстоятельно излагается в его статье "Классификация вод и ее графическое оформление"1 и в трудах Геофизического общества2. Согласно классификации С. А. Дурова, все природные воды делятся на пять классов:
1 (С. А. Дуров. Классификация вод и ее графическое оформление. М., Трансжелдориздат, 1948.)
2 (Тр. Американского геофизического общества, 37, № 2, 193 (1956).)
I. Первичные воды. Они происходят в результате действия атмосферных осадков на поверхности земли, которые выщелачивают растворимые соли. Эти воды, содержащие углекислый газ, легко растворяют известняки и доломиты, поэтому быстро достигается состояние химического равновесия по отношению к растворам бикарбонатов кальция и магния.
Первичные воды - слабо минерализованные - 100-300 мг/л и меньше. Отношение в них солей кальция к солям магния меняется от 5 до 10.
В водах I класса сульфаты и хлориды почти отсутствуют, а если присутствуют, то в очень малых количествах.
II. Вторичные воды. Происходят от обогащения первичных вод сульфатами и хлоридами натрия или магния, которые присутствуют в осадочных породах. Минеральность воды увеличивается до 100-500 мг/л. Жесткость тоже изменяется, так как отношение ионов кальция к ионам магния уменьшается от 3,0 до 1,4. Вторичные воды содержат сульфат кальция - результат прямого растворения природного гипса или же образующегося по следующим реакциям:
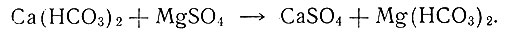
III. Сульфатные воды. Образуются из вторичных вод путем удаления из них бикарбонатов. Накопление вторичных вод в закрытых бассейнах происходит в результате превращения бикарбонатов в слегка растворимые карбонаты, которые осаждаются. Дальнейшая концентрация таких вод при определенных условиях дает начало сульфатным озерам. Удаление из вторичных вод карбонатов может происходить и в результате окисления пирита. Продукты окисления пирита - серная кислота и сульфат железа превращают бикарбонаты магния и кальция в сульфаты.
Переходные воды между классами II и III содержат бикарбонаты магния и кальция и сульфат магния. Эти воды сильно корродируют паровые котлы.
IV. Хлоридные воды. Возникают они в результате обогащения хлоридами и одновременной потери бикарбонатов и сульфатов. Обеднение указанными солями обусловлено осаждением карбоната кальция, доломита и сульфата кальция. Обычно таким путем вторичные воды переходят в хлоридные, которые содержат преимущественно хлориды щелочных и щелочноземельных металлов. Эти воды более устойчивы. Образуются они при постепенном испарении природных вод в закрытых бассейнах. Их возникновение связано с катионным обменом, сдвинутым в сторону образования кальция и магния.
V. Щелочные бикарбонатные воды. Они могут происходить из вторичных вод через коллоидально-химическое удаление ионов кальция, магния и сульфат-иона. Такие воды не содержат сульфатов. По-видимому, протекающие в них биохимические процессы способствуют образованию этих вод в природе. Характерная их особенность - низкие минеральность, жесткость и повышенное отношение содержания солей кальция к солям магния. При увеличении в "их концентрации бикарбонатов щелочных металлов такие воды дают начало содовым озерам.
Заслуживает большого внимания совместная работа С. А. Дурова и Н. А. Федоровой об источниках ионного строения атмосферных осадков в СССР. Согласно выводам авторов1, морские воды содержат лишь около 27% всех солей, присутствующих в атмосферных осадках. Остальное количество солей в виде бикарбонатов и сульфатов может образоваться в континентальной среде. Бикарбонатные и сульфатные природные воды, однако, содержат и некоторое количество примесей в виде хлоридов из остатков морей геологического прошлого. Эти же авторы показали, что основная часть солей атмосферных осадков СССР обязана своим происхождением пыли и аэрозолям, которые приносятся в основном из засушливых частей континента.
1 (С. А. Дуров, Н. А. Федорова. Доклады АН СССР, 92, № 2, 401 (1953).)
В результате многолетнего изучения природных и котловых вод Юго-Востока Российской Федерации и Северного Кавказа С. А. Дуров разработал новый метод обработки гидрохимических материалов. Основой метода является известное положение физико-химического анализа, согласно которому "между химическими превращениями веществ и геометрическими преобразованиями пространства существует полная аналогия". Исходя из этого, С. А. Дуров предложил треугольную форму выражения результатов единичных водных анализов, которая очень успешно была применена к .классификации природных вод. Обстоятельное описание этого метода дается в монографии "Геометрический метод в гидрохимии"1.
1 (С. А. Дуров. Геометрический метод в гидрохимии. Ростиздат, 1959.)
После окончания Великой Отечественной войны научная деятельность С. А. Дурова протекает в Новочеркасском политехническом институте. В общей сложности он опубликовал более ста работ. Для его исследований характерно гармоничное сочетание теоретических изысканий и практическое приложение их. Наглядным примером этого может служить его совместная работа с Л. Н. Аверьяновой "К вопросу образования силикатных накипей в паровозных котлах"1. При решении этой задачи применено рентгенографическое исследование фазового состава осадков, образующихся в паровозных котлах. Оно позволило установить, что силикатные накипи по своему составу неодинаковы и их природа прежде всего обусловлена качеством питательных вод. Авторы представили механизм образования накипей и рекомендации по борьбе с ними.
1 (Л. Н. Аверьянова. К вопросу образования силикатных накипей в паровозных котлах. Автореферат диссертации на соискание ученой степени кандидата химических наук. Новочеркасск, 1903.)
Целенаправленно и результативно развернулись работы по физико-химическому анализу с 1938 т., когда кафедрой общей и неорганической химии по совместительству стал заведовать старший научный сотрудник ИОНХа Академии наук СССР профессор Андрей Георгиевич Бергман - ученик академика Н. С. Курнакова. Он привлек всех работников кафедры >к изучению гетерогенного равновесия солевых систем в расплавах различными методами физико-химического анализа. Вся тематика кафедры была тесно связана с направлением работ Института общей и неорганической химии АН СССР.
А. Г. Бергман получил высшее образование в Петербургском университете, естественное отделение физмата которого окончил в 1918 г. Научной работой он начал заниматься с 1916 т., избрав темой исследования полимеризацию пиррола и его производных, но под влиянием идей академика Н. С. Курнакова перешел к изучению физико-химического анализа. Им написано много статей по химии расплавленных солей, водных соляных равновесий и физико-химическому анализу систем с органическими компонентами. Обстоятельным результатом его работы, совместно с Н. С. Домбровской, явилась классификация взаимных систем1, согласно которой все взаимные системы подразделяются на 3 вида:
- Обратимо-взаимные системы, характеризующиеся величиной условно вычисленного термического эффекта реакции обмена от 0 до 2 ккал/экв. В таких системах обменное равновесие обратимо, и из расплава выделяются на обеих диагоналях продукты обмена.
- Необратимо-взаимные системы. Здесь термический эффект реакций обмена от 2 до 8 ккал/экв. В этом случае равновесие системы односторонне не сдвинуто, продукты обмена из расплавов стабильных компонентов не выделяются, а стабильная диагональ делит взаимную систему на две тройные.
- Сингулярно необратимые взаимные системы. Величина термического эффекта реакций обмена в такого типа системах больше 10 ккал/экв. Для этого типа систем характерна полная обратимость реакций, сильное одностороннее смещение равновесия и частое расслоение.
1 (А. Г. Бергман, Н. С. Домбровская. ЖРФХО, 61, 1451 (1929).)
Дальнейшее накопление огромного фактического материала позволило автору расширить рассмотренную классификацию новым типом диагональных и адиагональньих взаимных систем. Образование такого вида систем связано с преобладанием термического эффекта реакции обмена, или комплексообразованием.
Являясь крупным специалистом в области физико-химического анализа расплавленных и водных растворов солей, профессор А. Г. Бергман объединил большой коллектив работников многих вузов и организовал их на выполнение исследований по физико-химическому анализу. Огромный накопленный им с учениками и сотрудниками фактический материал систематически освещается в периодических научных изданиях. В общей сложности им опубликовано около 300 статей, которыми охватываются следующие разделы физико-химического анализа: бинарные, тройные и четверные системы; обменное разложение в отсутствии растворителя; получение термофосфатов; применение расплавленных солей (флюсы, термические ванны, теплоносители); физико-химические свойства расплавленных солевых систем; водные солевые системы; равновесия природных солей; соляные ресурсы СССР; системы с органическими компонентами.

А. Г. Бергман
Совместно с Н. П. "Нужной А. Г. Бергман в монографии "Физико-химические основы изучения и использования соляных месторождений хлорид-сульфатного типа" обобщил обширный материал о соляных месторождениях хлорид-сульфатного типа, включив в нее результаты своих исследований и описание физико-химических основ изучения и использования природных залежей солей.
К этому времени научной деятельности А. Г. Бергмана в Ростовском университете относятся его работы по физико-химическому анализу, проведенные с Н. К. Товмосьяном, Л. Н. Успенской. Позже эти исследования были оформлены в диссертации, успешно защищенные на соискание ученой степени кандидата химических наук.
Наряду с организацией научно-исследовательской работы профессор А. Г. Бергман читал курс физико-химического анализа для научных работников и студентов неорганической специальности.
О дальнейшей научной деятельности А. Г. Бергмана будет сказано ниже.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'