
Кинетика образования водорода клетками гидрогеназосодержащих микроорганизмов
Нами проведено экспериментальное изучение кинетики выделения водорода гидрогеназой клеток бактерий Т. roseopersicina Pr. aestuarci и Al. eutrophus. В качестве субстрата использовали 4,4'-диметилдипиридинхлорид (метилвиологен), восстановленный дитионитом натрия. Кинетика и механизм действия гидрогеназ в растворе, выделенных из клеток Т. roseopersicina, описана выше.
Препараты клеток хранили в замороженном виде при -8°С. Суспензию клеток для кинетических измерений готовили непосредственно перед опытом. В предварительном эксперименте было показано, что гидрогеназы в клетках в условиях эксперимента достаточно стабильны. В течение 40 сут не наблюдалось сколь-нибудь заметного уменьшения активности фермента. Изучение кинетики образования молекулярного водорода проводили в термостатированных периодического действия реакторах, допускающих продувку раствора инертным газом и отбор проб из газовой фазы.
Суспензию клеток определенной концентрации в 0,1 М фосфатном буферном растворе; pH 7,8; 30°С, содержащем заданную концентрацию метилвиологена в окисленной форме, предварительно продували аргоном в течение одного-двух часов при интенсивном перемешивании. Реакцию инициировали добавлением известного количества дитионита натрия, избыточного по отношению к метилвиологену.
Основное сопротивление массопереносу в зависимости от условий проведения процесса могут оказывать: а) внешнедиффузионный слой, б) внешняя цитоплазматическая мембрана, в) внутренняя мембранная система клетки. Внешнедиффузионный слой, возникающий на границе твердое тело - движущаяся жидкость, в обычных условиях проведения кинетического эксперимента (перемешивание) имеет порядок 10-50 мкм при размере частиц в несколько микрон. Надежным экспериментальным критерием наличия или отсутствия внешнедиффузионных эффектов является зависимость скорости реакции (или других кинетических характеристик) от условий перемешивания суспензии клеток с раствором субстрата.
Типичные кинетические кривые образования молекулярного водорода в присутствии клеток Т. roseopersicina представлены на рис. 25. После определенного периода индукции реакция переходит в стационарный режим, характеризуемый постоянной скоростью выделения водорода. Экспериментально были изучены зависимости кинетики выделения водорода от концентрации субстрата, дитионита натрия, клеток, скорости вращения мешалки в реакторе. Стационарная скорость образования водорода линейно зависит от концентрации клеток. Реакцию образования водорода проводили в режиме максимальной скорости, когда скорость выделения водорода не зависит ни от концентрации метилвиологена, ни от концентрации дитионита натрия (рис. 26).
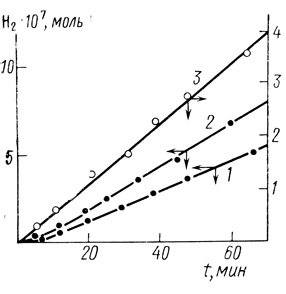
Рис. 25. Типичные кинетические кривые выделения водорода гидрогеназой клеток Т. roseopersicina. Условия: дитионит натрия - 1,2⋅10-2 М; метилвиологен - 1,5⋅10-3 М; концентрация клеток 1 - 1,5⋅106 мл-1, 2 - 2,6⋅106 мл-1; 3 - экстракт клеток после разрушения ультразвуком
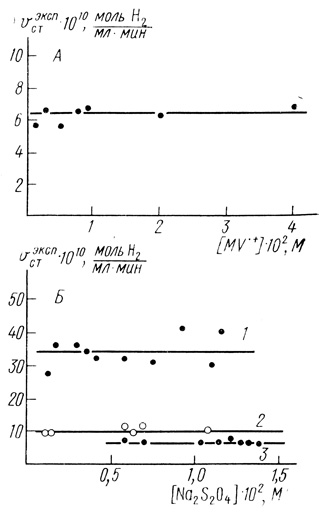
Рис. 26. Зависимость стационарной скорости образования водорода гидрогеназой в клетках Т. roseopersicina: А - от концентрации восстановленной формы метилвиологена; концентрация дитионита натрия 1,2⋅10-2 М; концентрация клеток 1,3⋅106 мл-1; Б - от концентрации дитионита натрия: 1 - концентрация клеток 1,3⋅107 мл-1, концентрация метилвиологена - 10-3 М; 2 - концентрация клеток 2,6⋅106 мл-1; 3 - концентрация клеток 1,3⋅106 мл-1, концентрация метилвиологена 9⋅10-3 М
При кинетических экспериментах с клетками достаточно сложно элиминировать эффекты внешнедиффузионного торможения реакции. В нашем случае эти эффекты были исключены высокими концентрациями субстратов и достаточно эффективным перемешиванием. Основные измерения проведены в условиях, когда ни стационарная скорость реакции, ни период индукции не зависят от скорости вращения мешалки в реакторе (рис. 27).
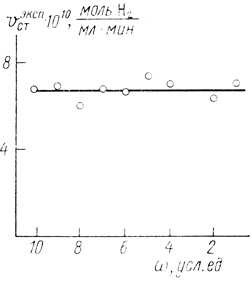
Рис. 27. Зависимость максимальной скорости выделения водорода клетками Т. roseopersicina от скорости вращения мешалки
Наблюдаемый на кинетической кривой выделения водорода период (τ = 5,0±1,5 мин) в соответствии с развитой моделью был интерпретирован как отражение процесса диффузионного переноса водорода через клеточную мембрану в водную фазу. На это указывает тот факт, что τ не зависит от последовательности смешения компонентов реакционной смеси клеток, метилвиологена, дитионита натрия. Кроме того, реакция выделения водорода с использованием экстракта из клеток с разрушенной мембраной протекает без характерного периода индукции (см. рис. 25).
Клетки Т. roseopersicina являются сферами радиуса 1,4 мкм [391]. На основании полученных кинетических данных были определены параметры действия клеток как биокаталитической системы.
Важным результатом представляется определение проницаемости клеточной мембраны Т. roseopersicina для водорода. Эта величина оказалась сравнительно малой. В силу этого "кинетическая" стационарная концентрация водорода в клетке при работе фермента в режиме максимальной скорости весьма высока - 0,15 М, что в 200 раз выше равновесной концентрации водорода в воде при нормальном давлении и в 30 раз больше, чем в органических растворителях [392]. Очевидно, что это обеспечивает термодинамические и кинетические режимы протекания процессов, которые невозможны в обычных условиях.

Величина максимального потока водорода в расчете на одну клетку - весьма важный параметр, который не зависит от модели, выбранной для интерпретации полученных результатов. При высоких "насыщающих" концентрациях субстрата в условиях определения максимального потока система работает в кинетическом режиме, и эффекты внешнего мембранного или внутреннего массопереноса не проявляются в регистрируемой скорости реакции. Это позволяет объективно сравнивать активность внутриклеточных ферментов различных групп и штаммов микроорганизмов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'