
1. Кинетическая модель биоэлектрокатализа
При анализе эффектов ускорения электродных процессов ферментами в первую очередь необходимо учесть гетерогенный характер системы. В работе [528] дан анализ биоэлектрокаталитических эффектов на основе следующей идеализированной модели. Предполагалось, что фермент равномерно распределен по поверхности электрода с поверхностной концентрацией ES (м/см2), при этом лимитирующей стадией процесса является ферментативная реакция
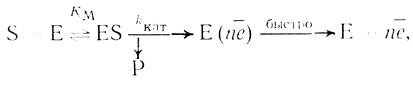 (4.1)
(4.1)где ES - фермент-субстратный комплекс; Е (ne‾) - состояние активного центра фермента, акцептировавшего (или лишенного) электронов. Предполагалось, что поверхность с иммобилизованным ферментом однородна и равнодоступна. С учетом существования на границе раздела фаз твердое тело - движущаяся жидкость диффузионного слоя толщиной δd в стационарном состоянии величина удельного тока, снимаемого с электрода, определяется уравнением
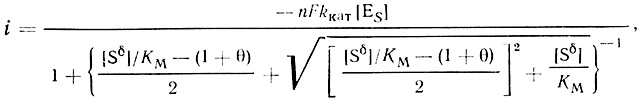 (4.2)
(4.2)где [Sδ] - концентрация субстрата в объеме; θ - безразмерный модуль, определяемый по уравнению
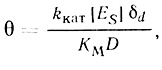 (4.3)
(4.3)где D - коэффициент диффузии субстрата; F - число Фарадея; n - число переносимых электронов на молекулу субстрата.
Величина отношения [S0]/[Sδ] ([S0] - концентрация субстрата у поверхности электрода) дается уравнением
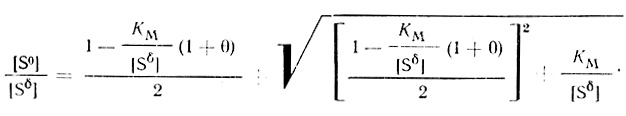 (4.4)
(4.4)Это отношение определяет концентрационную поляризацию электрода
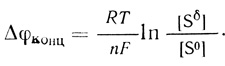 (4.5)
(4.5)Использование уравнения (4.3) при известных константах ферментативной реакции и макрокинетических характеристиках δd и D позволяет рассчитать каталитические свойства электрода. Модуль 0 и отношение [Sδ]/KM регулируют, в какой области - диффузионной или кинетической - работает система. В зависимости от величины этих параметров отношение [S0]/[Sδ] может быть близко к единице или много меньше единицы.
1. Если θ << 1, т. е. мал кинетический параметр kкат/КМ, или мала поверхностная концентрация фермента ES, или мало отношение δd/D, отношение [S0]/[Sδ] равно единице. В этих условиях вне зависимости от [S0] концентрация субстрата на поверхности равна его объемной концентрации. Система работает в кинетическом режиме. Величина тока прямо пропорциональна поверхностной концентрации фермента. В предел при "насыщающих" концентрациях субстрата [Sδ]KM величина снимаемого с электрода "каталитического" тока равна
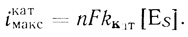 (4.6)
(4.6)2. Если θ >> 1, в зависимости от отношения КМ/[Sδ] величина [S0]/[Sδ] может быть соизмерима или много меньше единицы. При соизмеримых величинах КМ и [Sδ]
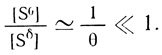 (4.7)
(4.7)Однако, если KM[Sδ] << 1, так что (KM/[Sδ])θ << 1, [S0]/[Sδ] → 1). Таким образом, необходимым условием того, чтобы система работала в диффузионном режиме, является θ >> 1, необходимым и достаточным
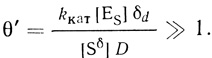 (4.8)
(4.8)В таком случае удельный предельный диффузионный ток равен
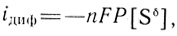 (4.9)
(4.9)где Р - проницаемость диффузионного слоя:
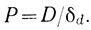 (4.10)
(4.10)Как и обычную гетерогенно-каталитическую реакцию в рамках рассмотренной модели процесс электрокаталитического переноса электронов можно охарактеризовать коэффициентом каталитической эффективности
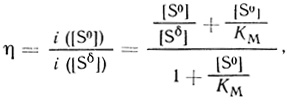 (4.11)
(4.11)который зависит от диффузионного модуля θ и внешней концентрацией субстрата (рис. 57). При высоких концентрациях субстрата и θ < 1 коэффициент эффективности близок к единице, [S0]/(Sδ] ≈ 1, Δφконц = 0. При низких концентрациях субстрата и высоких значениях диффузионного модуля коэффициент эффективности дается уравнением
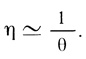 (4.12)
(4.12)![Рис. 57. Каталитическая эффективность гетерогенного катализатора как функция модуля 0 при различных значениях S6/KM: 1 - 0,1; 2 - 0,2; 3 - 0,5; 4 - 1,0; 5 - 10 [528]](pic/000298.jpg)
Рис. 57. Каталитическая эффективность гетерогенного катализатора как функция модуля θ при различных значениях Sδ/KM: 1 - 0,1; 2 - 0,2; 3 - 0,5; 4 - 1,0; 5 - 10 [528]
Проведенный анализ позволяет сделать несколько выводов:
1. Предельный "каталитический" ток, который должен наблюдаться при θ << 1, определяется поверхностной концентрацией и эффективностью каталитического действия фермента. При монослойном заполнении поверхности электрода белком средних размеров поверхностная концентрация его соответствует ∼1⋅10-11 м/см2. Если лимитирующая константа скорости ферментативного превращения близка к 103 с-1, предельный каталитический ток будет равен 1 мА/см2.
Важно подчеркнуть, что кинетический режим работы электрода может достигаться либо уменьшением диффузионного модуля (при данной активности и концентрации фермента, что означает уменьшение δd) или при заданном макрокинетическом режиме работы путем увеличения концентрации субстрата. В кинетическом режиме отсутствует концентрационная поляризация электрода.
2. На основе уравнения (4.9) можно оценить величину предельного диффузионного тока. Для численной оценки примем, что проницаемость диффузионного слоя равна 10-3 см/с. Это соответствует массопереносу компонента с коэффициентом 5⋅10-6 см2/с через диффузионный слой 50 мкм. По порядку величины принятый коэффициент диффузии соответствует значениям, характерным для диффузии низкомолекулярных веществ в водных растворах. Толщина диффузионного слоя при проведении эксперимента с истинно равнодоступной поверхностью, каковой является вращающийся дисковый электрод, соответствует скорости вращения 10 об/с [529]. Предельный диффузионный ток, который должен наблюдаться при работе электрода в диффузионном режиме (θ >> 1, [Sδ] << KM), равен 0,1 мА/см2 при [Sδ]∼10-3 м/л. Эта оценка подчеркивает важность макрокинетических характеристик электрода.
3. Представляет интерес оценка минимальной концентрации активных центров электрокатализатора на поверхности электрода, позволяющая перевести реакцию в диффузионный режим при предельных кинетических параметрах каталитической стадии. Как известно, предел скорости биомолекулярных реакций в растворе и соответственно предел бимолекулярных стадий каталитических реакций есть скорость молекулярной диффузии молекул в растворе, характеризуемая константой скорости 1010 М-1⋅с-1. Пределом параметра kкат/КМ для ферментативных реакций также является эта величина. Для "проницаемость" диффузионного слоя δd около 10-3 см/с минимальная концентрация активных центров, "работающих" с kкат/КМ = 1010 М-1⋅с-1, дается неравенством
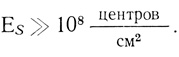 (4.13)
(4.13)При концентрации активных центров выше 1⋅10-6 м/см2 скорость каталитической стадии настолько высока, что кинетика процесса в целом определяется диффузией субстрата. Очевидно, что в этих условиях очень небольшая доля поверхности может выполнить каталитическую функцию. Если в качестве катализатора выступает атом (или группа атомов) металла на поверхности электрода, как это наблюдается, например, в реакциях на платиновых электродах, и если катализ протекает с kдиф = 1010 М-1⋅с-1, доля "каталитически активных" атомов равна 10-8.
При электрокатализе ферментами в силу полимерного характера катализаторов степень заполнения поверхности электрода катализатором существенно выше. Если принять, что при плотной упаковке с образованием монослоя поверхностная концентрация фермента равна 10-11 м/см2, при работе фермента с kкат/KМ = 1010 М-1⋅с-1, степень заполнения поверхности равна 10-3%.
В реальных системах для различных ферментов значения kкат/KМ варьируются в широких пределах от 109 М-1⋅с-1 до 102 М-1⋅с-1 (см. главу II). Условно все ферменты можно разбить на три основные группы: 1 - малоактивные, имеющие kкат/КМ < 104 М-1⋅с-1, 2 - активные с kкат/KМ в диапазоне 107-104 М-1⋅с-1 и 3 - высокоактивные, для которых kкат/KМ выше 107 М-1⋅с-1. При заданных выше макрокинетических характеристиках (Р = 10-3 см/с) для ферментов третьей группы при монослойном заполнении поверхности электрода и при использовании концентраций субстрата, соизмеримых с KМ, скорость ферментативной реакции будет существенно превышать скорость диффузии, и фермент работает в строго диффузионном режиме. Существенное уменьшение поверхностной концентрации фермента вплоть до 1% заполнения поверхности не должно заметно изменить регистрируемую скорость процесса.
Ферменты первой группы в силу низких значений kкат/KМ при любой концентрации субстрата будут работать в кинетическом режиме. При этом скорости реакции и соответственно каталитические токи относительно невелики. Резервы в увеличении эффективности действия ферментов этого класса лежат в получении полислоев катализаторов.
Очевидно, что ферменты, имеющие кинетические параметры в промежуточной области 107 М-1⋅с-1 < kкат/KМ 104 М-1⋅с-1, в зависимости от условий эксперимента могут проводить реакцию как в диффузионном, так и в кинетическом режиме.
Таким образом, анализ кинетической модели действия ферментов в электрохимической системе показывает, что при использовании ферментов могут быть реализованы весьма высокие плотности токов. При этом наиболее существенно, что при работе в каталитическом режиме отсутствует концентрационная поляризация и имеются широкие возможности увеличения характеристик электрода за счет макрокинетических факторов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'