
2. Механизмы переноса электронов между активным центром фермента и электронпроводящей матрицей
Рассмотренная схема катализа ферментами электрохимических реакций (4.1) в достаточной степени идеализирована. Наиболее важным является предположение о том, что активный центр фермента способен быстро и обратимо обмениваться электронами с электродом. Осуществление такого рода процессов - необходимое условие получения электрокаталитических эффектов с помощью ферментов.
Транспорт электронов активный центр фермента - электрод можно осуществить по двум принципиально различным механизмам [526, 530].
1. Перенос электронов может быть реализован с помощью диффузионно подвижного промежуточного низкомолекулярного переносчика электронов - медиатора. Схему процесса в этом случае можно представить в виде
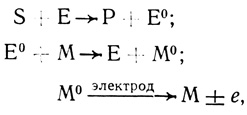 (4.14)
(4.14)где S и Р - исходный субстрат и конечный продукт электрохимической реакции; Е и Е0 - окисленная и восстановленная форма активного центра фермента; М, М0 - окисленная и восстановленная форма медиатора.
В работе [530] сформулированы основные требования, которым должен удовлетворять медиатор для того, чтобы электрокаталитический процесс был наиболее эффективным. Медиатор должен быть достаточно специфическим субстратом используемого фермента, электрохимически активен на электроде из данного материала. Окислительно-восстановительный потенциал медиатора должен быть близок к окислительно-восстановительному потенциалу используемого топлива или окислителя. Важно, чтобы медиатор был стабилен с точки зрения деструктивных процессов. Возможности медиаторного переноса электронов исследованы нами в трех системах.
1) В реакции электрохимической ионизации водорода на угольных электродах под действием гидрогеназ [530, 531] (см. ниже "Ферментативное электрохимическое окисление водорода"); 2) в реакции электрохимического восстановления кислорода с помощью лакказы; 3) в реакции электрохимического восстановления перекиси водорода пероксидазой, активируемой ионами марганца [526].
Рассмотрим механизм электрокаталитического действия фермента с медиатором на примере электрохимического восстановления кислорода с помощью пероксидазы [526].
Предварительные опыты с пероксидазой показали, что фермент не катализирует реакцию электрокаталитического восстановления кислорода на пирографитовом электроде. При насыщении раствора фермента кислородом были измерены поляризационные кривые, при этом практически не наблюдалось различие между кривыми в присутствии и в отсутствие фермента. При добавлении в систему окислительной пары хинона/гидрохинона и ионов Mn2+ наблюдается существенное смещение стационарного потенциала в положительную область приблизительно на 300 мВ и возрастание скорости электродного процесса (рис. 58). Для сравнения на рис. 58 приведены поляризационные кривые электровосстановления кислорода на пирографите и электровосстановления хинона без катализатора. В присутствии гидрохинона схему процесса можно представить в виде
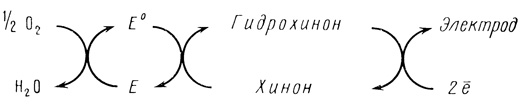 (4.15)
(4.15)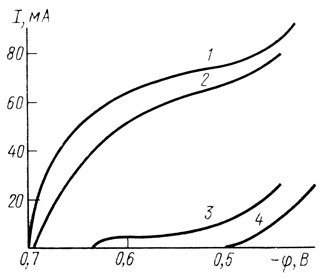
Рис. 58. Катодные поляризационные кривые в системе кислород - гидрохинон - пероксидаза - пирографитовый электрод: 1 - в присутствии пероксидазы (0,5 мг/мл) и ионов марганца; 2 - без ионов марганца; 3 - катодное восстановление хинона; 4 - катодное восстановление кислорода; pH 7,2; 0,01 М фосфата натрия; 25°С
В этой системе пара гидрохинон/хинон играет роль низкомолекулярного переносчика электронов между электродом и активным центром фермента.
2. В наших работах показано, что возможен прямой электрокаталитический перенос электронов между электродом и активным центром фермента. Так, в атмосфере кислорода в присутствии лакказы Poluporos versicolor, сорбированной на электродах из различных материалов, устанавливается потенциал, близкий к термодинамическому потенциалу кислорода. Лакказа катализирует электрохимическое четырехэлектронное восстановление кислорода, при этом существует стадия переноса электронов из электрода на активный центр фермента (см. ниже "Ферментативное электрохимическое восстановление кислорода").
Обратимые электрохимические реакции белков на электродах - достаточно известное явление. Например, Кузнецовым и др. [532] описан электрохимический процесс с участием гемопротеинов, в работах Бетсо и др. [533] изучены электрохимические свойства цитохрома, Киселевым и др. [534] проведено электрохимическое восстановление ферредоксина, Шеллером и др. [535, 536] детально исследована реакция электрохимического восстановления гем-содержащих белков на ртутных электродах. Эти данные показывают, что существует принципиальная возможность прямого переноса электронов с электрода на активные центры ферментов.
В наших исследованиях процессы переноса электронов между активными центрами ферментов и электродами исследовались как по электрокаталитическим эффектам (в случае лакказы), так и по прямым электрохимическим измерениям в потенциодинамическом режиме.
При исследовании прямого электронного обмена с участием ферментов необходимо сопоставление электрохимических и каталитических данных. В работе [537] нами было проведено изучение электрохимических свойств пероксидазы. На рис. 59 приведены потенциодинамические кривые пероксидазы на амальгамированном золотом электроде. В условиях эксперимента наблюдается обратимый электрохимический процесс. При этом количество электричества, идущее на восстановление фермента, является функцией концентрации фермента и выходит за предел, определяемый заполнением поверхности электрода ферментом (рис. 60). Потенциодинамические кривые пероксидазы на пирографитовом электроде при различных значениях pH приведены на рис. 61.
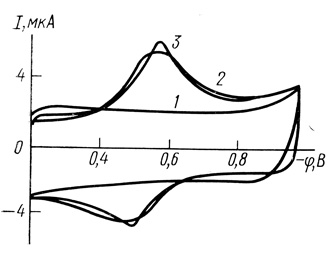
Рис. 59. Потенциодинамические кривые пероксидазы на амальгамированном золотом электроде: 1 - фоновая кривая; 2 - кривая в растворе пероксидазы; 3 - кривая после выдерживания при потенциале - 1,100 В; pH 6,9
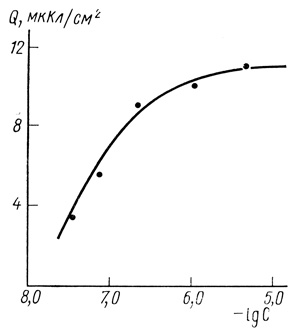
Рис. 60. Зависимость количества электричества, расходуемого на восстановление пероксидазы, от концентрации фермента; pH 6,9
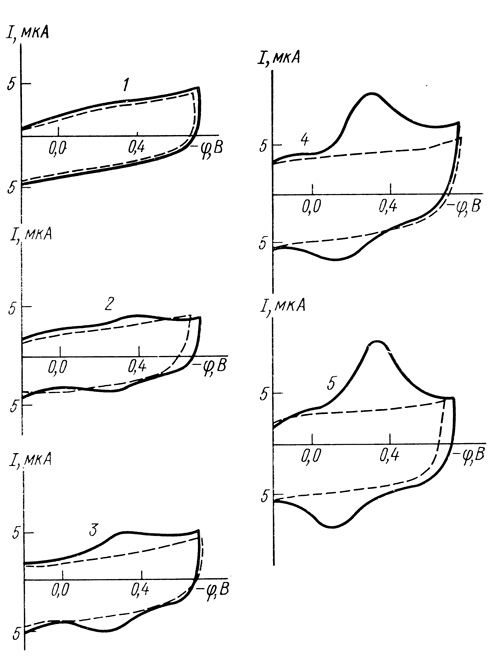
Рис. 61. Потенциодинамические кривые пероксидазы на пирографитовом электроде при pH: 1 - 6,9; 2 - 3,9; 3 - 3,45; 4 - 2,25; 5 - 2,4; кривая в растворе гемина; пунктиром обозначены фоновые кривые
Однако детальное изучение процесса, сопоставление электрохимических данных со спектроскопическими, электрохимическое исследование апопероксидазы показало, что электродный процесс не включает перенос электрона на гем в активном центре фермента, а представляет собой, по-видимому, восстановление дисульфидных связей белка. Так, электрохимическое восстановление пероксидазы не сопровождается спектральными изменениями, характерными для восстановления гемина в активном центре. Электрохимический процесс, близкий по параметрам к нативному ферменту, наблюдается для апопероксидазы (рис. 62). Интересно отметить, что гемин достаточно эффективно электрохимически восстанавливается в растворе и теряет такую способность при комплексообразовании с апоферментом. Таким образом, белковая молекула в случае пероксидазы обеспечивает высокий кинетический барьер для переноса электронов с электрода на активный центр фермента.
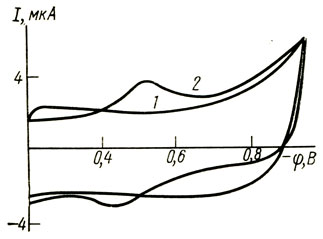
Рис. 62. Потенциодинамическая кривая апопероксидазы на амальгамированном золотом электроде при pH 6,9: 1 - фоновая кривая; 2 - кривая в растворе апопероксидазы
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'