
Электрохимическая кинетика восстановления кислорода с помощью лакказы
При экспериментальном изучении зависимости тока от потенциала в потенциалостатическом режиме при различных концентрациях ионов водорода и парциальных давлениях кислорода были обнаружены следующие закономерности.
1. Скорости и соответственно токи электрохимического восстановления кислорода в определенном диапазоне концентраций и потенциалов зависят от концентрации фермента. При малых Степенях заполнения поверхности эта зависимость имеет линейный характер от концентрации фермента, вводимого в раствор при иммобилизации. В этих условиях фермент практически необратимо адсорбируется на поверхности сажевого электрода и его поверхностная концентрация линейно связана с концентрацией вводимого в раствор фермента. Первый порядок скорости реакции от концентрации лакказы иллюстрирует рис. 82. Линейная связь между скоростью реакции и концентрацией фермента наблюдается в диапазоне потенциалов 0,6-1,2 В, определенных по водородному электроду в том же растворе. В области этих потенциалов лимитирующей является ферментативная реакция. Пои более отрицательных потенциалах наблюдается смена лимитирующей стадии, величина тока становится непропорциональной количеству адсорбированного фермента. Можно думать, что реакция переходит в смешанную область и диффузионно-контролируемый режим. Все дальнейшее рассмотрение относится к области потенциалов линейной зависимости скорости реакции от концентрации фермента.
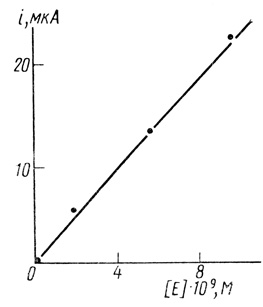
Рис. 82. Зависимость тока от концентрации лакказы, вводимой при необратимой иммобилизации фермента; потенциал 1,0 В; скорость вращения электрода 610 об/мин
2. "Классическим" подходом к изучению механизмов электрохимических реакций является исследование поляризационных кривых. На рис. 83 приведены типичные зависимости тока от потенциала для сажевых электродов с иммобилизованной лакказой (для одной серии экспериментов). Эти зависимости имеют экспоненциальный характер. Спрямление кривых рис. 83 в полулогарифмических координатах приведено на рис. 84. Эти данные показывают, что реакция электрохимического восстановления кислорода с помощью лакказы имеет характер "обычного" электрохимического процесса, скорость которого ускоряется потенциалом [554, 555].
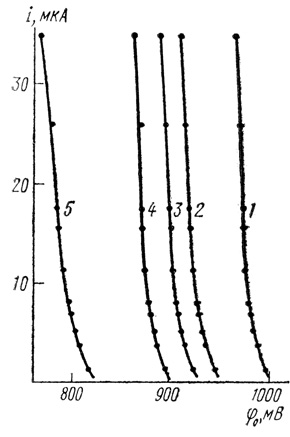
Рис. 83. Зависимости тока от потенциала для сажевых электродов с иммобилизованной лакказой, снятые при различных значениях pH: 1 - 3,05; 2 - 4,0; 3 - 4,5; 4 - 5,0; 5 - 6,05; 0,1 М нитрата калия; 0,05 М фосфата натрия; 0,05 ацетата натрия
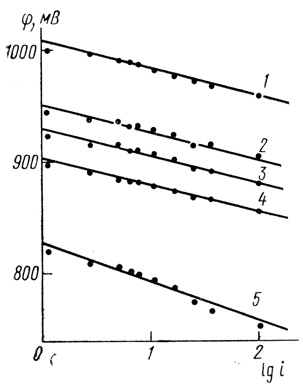
Рис. 84. Линеаризация данных в полулогарифмических координатах
3. Экспериментально была исследована зависимость стационарной скорости реакции (стационарного тока) от потенциала при различных значениях pH (рис. 84-86). Диапазон исследованных значений pH определяется возможностью установления в условиях эксперимента устойчивого стационарного состояния, характеризуемого устойчивым стационарным потенциалом. На рис. 85 видно, что ∂φ/∂lgi, найденное при статистической обработке результатов, равно
∂φ/∂lgi = 26 ± 3 мВ. (4.33)
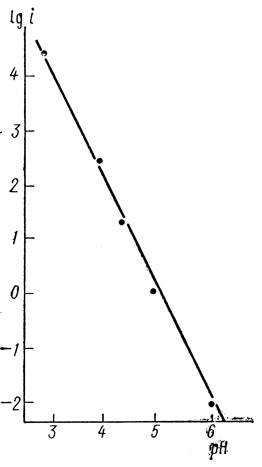
Рис. 85. Зависимость тока от pH при фиксированном потенциале (стационарном) 0,9 (данные рис. 83)
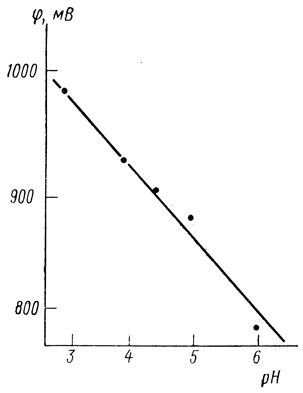
Рис. 86. Зависимость стационарного потенциала электрода от pH при фиксированном токе 17,5 мкА (данные рис. 83)
Значение потенциала при фиксированной величине снимаемого тока является линейной функцией pH (см. рис. 86):
∂φ/∂рН = 60 ± 7 мВ. (4.34)
Результаты, приведенные на рис. 85 и 86, дающие представление о зависимости скорости реакции от pH, можно представить в виде обычного кинетического уравнения. Функция скорости реакции от pH в логарифмических координатах приведена на рис. 86. Видно, что реакция в условиях эксперимента имеет второй порядок по концентрации ионов водорода (тангенс угла наклона зависимости от pH равен 2).
4. Была исследована зависимость скорости реакции от концентрации кислорода. При постоянном токосъеме (17 мкА) изучалась зависимость стационарного потенциала от парциального давления кислорода. Результаты экспериментов с тремя электродами различного приготовления приведены в табл. 29. Статистическая обработка результатов приводит к значению
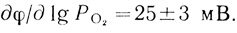
Таким образом, кинетические результаты можно представить в виде уравнений:
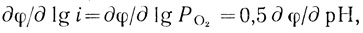 (4.35)
(4.35)или
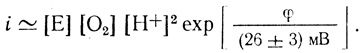 (4.36)
(4.36)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'