
Механизм электрохимического восстановления кислорода под действием лакказы
Теоретический анализ механизма реакции включает в себя поиск схемы процесса, описание которой приводит к кинетическим уравнениям (4.35, 4.36). При этом методологически правильным представляется обсуждение простейших схем реакции, удовлетворяющих экспериментальным данным, и последовательное усложнение механизмов при несоответствии получаемых выводов с экспериментальными результатами.
При анализе механизма каталитического действия лакказы в механизме восстановления кислорода были использованы следующие основные постулаты.
1. Активный центр фермента образует комплекс или химическое соединение с молекулой кислорода. На это указывает тот факт, что в механизме действия фермента не обнаружены в растворе полувосстановленные формы кислорода (свободные радикалы, перекись водорода [557]).
2. Реакции присоединения протона протекают в равновесном режиме и могут быть охарактеризованы константами равновесия. Это предположение обосновано многолетними исследованиями кинетики реакций переноса протона [262, 264].
3. Реакции переноса электрона с электрода на активный центр фермента представляют собой "обычные" электрохимические процессы, скорость которых определяется структурой двойного электрического слоя и потенциалом электрода. Для анодных и катодных процессов величины констант скорости можно представить соответственно в виде:
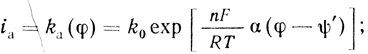 (4.37)
(4.37)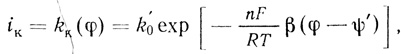 (4.38)
(4.38)где φ - потенциал, отсчитанный по стандартному электроду (например, водородному); α, β - безразмерные параметры, связанные соотношением α + β = 1, принимаемые равными 0,5; ψ' - потенциал диффузной части двойного слоя [554].
При поляризациях электрода, в потенциалах, отличных от равновесного, преимущественно преобладает один из процессов. В предположении, что ψ' - величина постоянная и малая, зависимость тока от потенциала представляется в виде
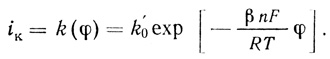 (4.39)
(4.39)В дальнейшем константа скорости электродного процесса переноса электрона будет обозначаться
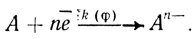 (4.40)
(4.40)Если электродный процесс протекает быстро и обратимо и может быть описан уравнением Нернста,
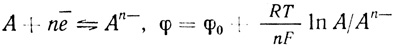 (4.41)
(4.41)константа, дающая отношение окисленной и восстановленной формы, будет обозначаться K(φ):
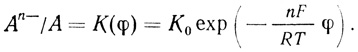 (4.42)
(4.42)Для простоты обсуждения механизмов важным представляется введение системы их классификации. В настоящей работе впервые для описания механизмов сложных химических и ферментативных реакций предложена и использована система, основанная на записи последовательности различных стадий процесса. Важным представляется то обстоятельство, что в стационарном состоянии в уравнение скорости реакции входят лишь параметры лимитирующих стадий и стадий, предшествующих определяющей скорость. Быстрые, нелимитирующие стадии процесса, следующие за наиболее медленной, не оказывают влияния на скорость реакции и не проявляются в кинетике процесса.
Экспериментально найденное уравнение скорости реакции электрохимического восстановления кислорода с помощью лакказы показывает, что скорость процесса имеет второй порядок по концентрации иона водорода. Это указывает на то, что определяющей скорость стадии предшествуют две стадии присоединения протона. Простейший механизм, который согласуется с этими фактами, включает стадии присоединения кислорода, двух протонов и кинетическую стадию восстановления активного центра:
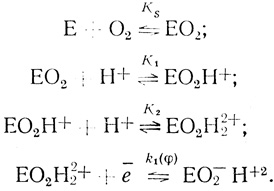 (4.43)
(4.43)В рамках предложенной систематики механизм (4.43) будет обозначен О2рре (кислород-протон-протон-электрон). В дальнейшем константы, определяющие кинетику реакции, будут представлены в виде: KS - константа диссоциации фермент-кислородного комплекса; К1, К2 - константы протолитических равновесий; k1(φ) - константа скорости электрохимического "разряда" (уравнение 4.39) ; К(φ) - константа, следующая из уравнения Нернста (уравнение 4.42).
Для схемы реакции (4.43) уравнение стационарной скорости имеет вид
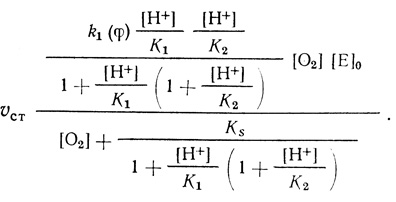 (4.44)
(4.44)Соответственно
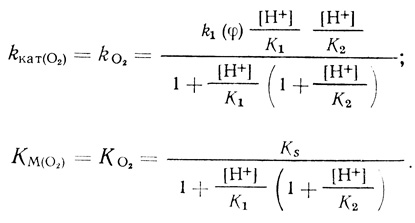 (4.45)
(4.45)Как следует из экспериментальных данных, реакция имеет первый порядок по кислороду. Это означает, что [О2] << КМ и скорость реакции описывается уравнением
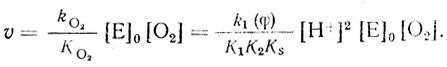 (4.46)
(4.46)С учетом уравнения (4.39)
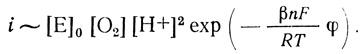 (4.47)
(4.47)Уравнение (4.47) описывает экспериментально наблюдаемую зависимость скорости реакции от концентрации фермента, кислорода, ионов водорода. Логарифмирование уравнения позволяет вычислить параметры реакции ∂φ/∂ lg i; ∂φ/∂ рН; ∂φ/∂ lg Ро2:
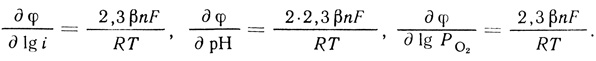 (4.48)
(4.48)При этом выполняется важное соотношение (4.35), которое является следствием второго порядка реакции по ионам водорода.
Можно показать, что в случае механизма, не включающего стадию присоединения протона до скорость определяющей стадии,
| ∂φ | ||
| ∂ pH |
будет равно нулю, в случае механизма с одной стадией - соблюдается соотношение
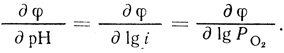 (4.49)
(4.49)Вариация последовательности стадий до скорость определяющей стадии приводит к формально отличным механизмам, однако неразличимым с точки зрения существующих экспериментальных данных. В табл. 37 приведены теоретические параметры механизмов О2рре, рO2ре, ррO2е. Видно, что при [H+] << K1 и соответственно при [H+] << K1 и [Н+] << K2 механизмы рO2ре и ррO2е также согласуются с экспериментальными данными.

Таблица 37. Кинетические параметры механизмов O2ppe, pO2pe и ppO2e
Таким образом, группа механизмов, приведенная в табл. 36, описывает наблюдаемую зависимость тока от концентрации ионов водорода. Тем не менее данные механизмы весьма маловероятны, поскольку из них следует, что "элементарная" стадия электрохимического восстановления активного центра фермента является четырехэлектронной. При β = 0,5 из уравнений (4.48) при сопоставлении с экспериментальными данными (∂φ/∂ lg i ∼- 26 ± 3 мВ) следует, что n = 4,5 ± 0,6. Перенос четырех электронов в одном элементарном акте - в высшей степени маловероятен, и в электрохимии не известны реакции, протекающие таким образом. Это заставляет внести некоторые усложнения в обсуждаемый механизм реакции. Можно думать, что кинетической стадии переноса электрона предшествуют быстрые, равновесные стадии, так что на скорость определяющей стадии число переносимых электронов существенно меньше единицы. Это предположение приводит к группе механизмов, согласующихся с экспериментальными данными.
В таблице 38 приведены механизмы этой группы. Индексом еn1eg обозначена быстрая равновесная стадия, включающая перенос n1 электронов с константой K(φ), индексом en2 - скорость определяющая стадия, включающая перенос n2 электронов. Механизмы О2en1eqрреn2, О2реn1eqреn2 и O2ppen1eqen2 различаются местом равновесной электрохимической стадии. Это приводит к несколько отличным друг от друга функциям kO2 и KO2. Однако проявляющийся в эксперименте параметр kO2/KO2 имеет один и тот же вид для всех трех механизмов. Для этих механизмов скорость реакции описывается уравнением
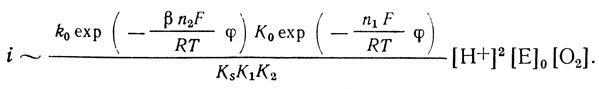 (4.50)
(4.50)В серии механизмов en1eqО2рреn2, еn1eqрO2реn2 и еn1eqррO2еn2 первой предполагается быстрое восстановление активного центра, при этом механизмы различаются местом стадии присоединения кислорода. Механизм еn1eqO2рреn2 также приводит к уравнению (4.50) при условии K(φ) << 1. Если K(φ) >> 1, кинетическое уравнение редуцируется в форму (4.47), из которой следует четырехэлектронный перенос на лимитирующей стадии реакции. Механизм en1eqрО2реn2, также приводит к уравнению (4.50) в условиях K1 >> [Н+], K(φ) << 1. Аналогично, при условии K(φ) << 1 [Н+] << K1, [Н+] << K2 кинетика процесса, протекающего по механизму еn1eqppО2еn2, описывается уравнением (4.50). В настоящее время нет экспериментальных свидетельств о величинах K(φ), К1, К2, поэтому на основе существующих данных эти механизмы неразличимы.
Принципиально важную информацию дает анализ численного значения ∂φ/∂ lg i, поскольку позволяет определить число электронов, переносимых на каждой из стадий.
Из уравнения (4.50) следует
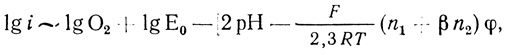 (4.51)
(4.51)или
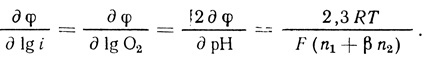 (4.52)
(4.52)Из сопоставления уравнения (4.52) с экспериментальными данными получаем:
n1 + βn2 = 2 (или при β = 0,5); (4.53)
n2 + 2n1 = 4. (4.54)
Поскольку n1, n2 - целые положительные величины, уравнение (4.54) дает неравенства n1 < 2, n2 < 4, с учетом которых единственным положительным целочисленным решением является
n1 = 1, n2 = 2. (4.55)
Механизм O2еn1eqрреn2 (один из механизмов, приведенных в табл. 38, который согласуется с экспериментальными данными) будет иметь вид:
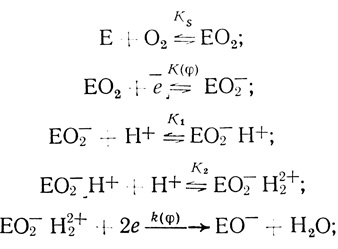 (4.56)
(4.56)далее: быстрые, нелимитирующие стадии.
Достаточно необычным представляется двухэлектронный перенос электронов с электрода на активный центр фермента на скорость определяющей стадии процесса (как правило, электрохимические реакции имеют одноэлектронный характер). Однако наличие двухэлектронной стадии в механизме действия лакказы согласуется со структурными исследованиями, согласно которым активный центр фермента содержит двухэлектронный акцептор, образуемый двумя ионами меди [551].
Таким образом, с помощью электрохимических измерений получена принципиально новая информация о механизме действия медьсодержащей оксидазы. В дальнейшем было проведено изучение кинетики гомогенного окисления лакказой субстратов различной природы, сопоставление электрохимических и химико-кинетических измерений с целью получения более полной картины молекулярного механизма действия катализатора.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'