
Стационарная кинетика окисления кислородом субстратов - доноров электрона
Была исследована кинетика окисления кислородом двух субстратов неорганического ферроцианид-иона и органического соединения - гидрохинона. При этом изучалась зависимость скорости гомогенного окисления в растворе от концентрации фермента, субстратов, ионов водорода. Кинетическое поведение системы характеризуется следующими закономерностями.
1. Зависимости начальной стационарной скорости реакции от концентрации доноров электрона имеют вид функции с "насыщением" и могут быть охарактеризованы величинами kкат и КМ. При этом значения kкат для двух субстратов различной природы практически совпадает (рис. 87).
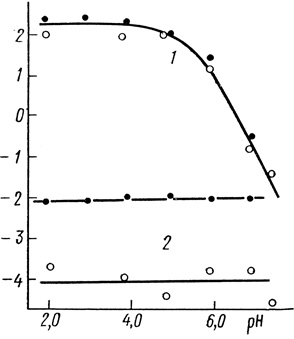
Рис. 87. Зависимость от pH параметров стационарной скорости окисления ферроцианида калия (●) и гидрохинона (○) кислородом в присутствии лакказы: 1 - lg kкат; 2 - lg KМ, 25°С; 0,05 М фосфата натрия; 0,05 М ацетата натрия
2. На рис. 87 приведена зависимость kкат и КМ от pH для обоих субстратов. Значение kкат контролируется ионогенными группами с рKа ∼ 5,5, при этом тангенс угла наклона pH-зависимости в елочной области pH равен 2. Величины КМ в исследованной области pH не зависят от концентрации ионов водорода.
Для объяснения этих закономерностей - "михаэлисовской" зависимости скорости от концентрации доноров различной природы с постоянным значением kкат для разных субстратов и рН-зависимости реакции необходимо ввести ряд новых усложнений в кинетический механизм реакции. Детальный анализ большого числа кинетических схем показывает, что "михаэлисовская" зависимость скорости реакции от концентрации донора, приводящая к величине kкат практически независящей от природы донора электрона, в рамках рассмотренных выше постулатов, возможна в механизме процесса с участием внутримолекулярной стадии изменения активного центра фермента.
Рассмотрим механизм электрохимического восстановления кислорода с точки зрения реакции окисления вводящихся в раствор органических и неорганических доноров электрона. Переход от электрохимической кинетики, характеризуемой константой k(φ), к процессу, протекающему в растворе, осуществляется, если положить, что стадии электрохимического восстановления активного центра в растворе представляют собой бимолекулярные стадии донирования электронов (k(φ) = k[D]). Это предположение экививалентно постулату о том, что механизм катализа в случае восстановления кислорода химическими донорами и электронами электрохимическим путем один и тот же.
Однако рассмотренная группа механизмов реакции, согласующаяся с экспериментальными электрохимическими данными, не описывает кинетику процесса гомогенного окисления. Анализ кинетических механизмов приведен в табл. 39. Предполагая, что k(φ) соответствует k1[D], процесс двухэлектронного восстановления, характеризуемый k(φ), в гомогенном случае представляет собой две последовательные стадии k2[D], k3[D] (ферроцианид-ион - одноэлектронный донор), можно видеть, что скорость реакции для всех механизмов - линейная функция концентрации донора электронов.
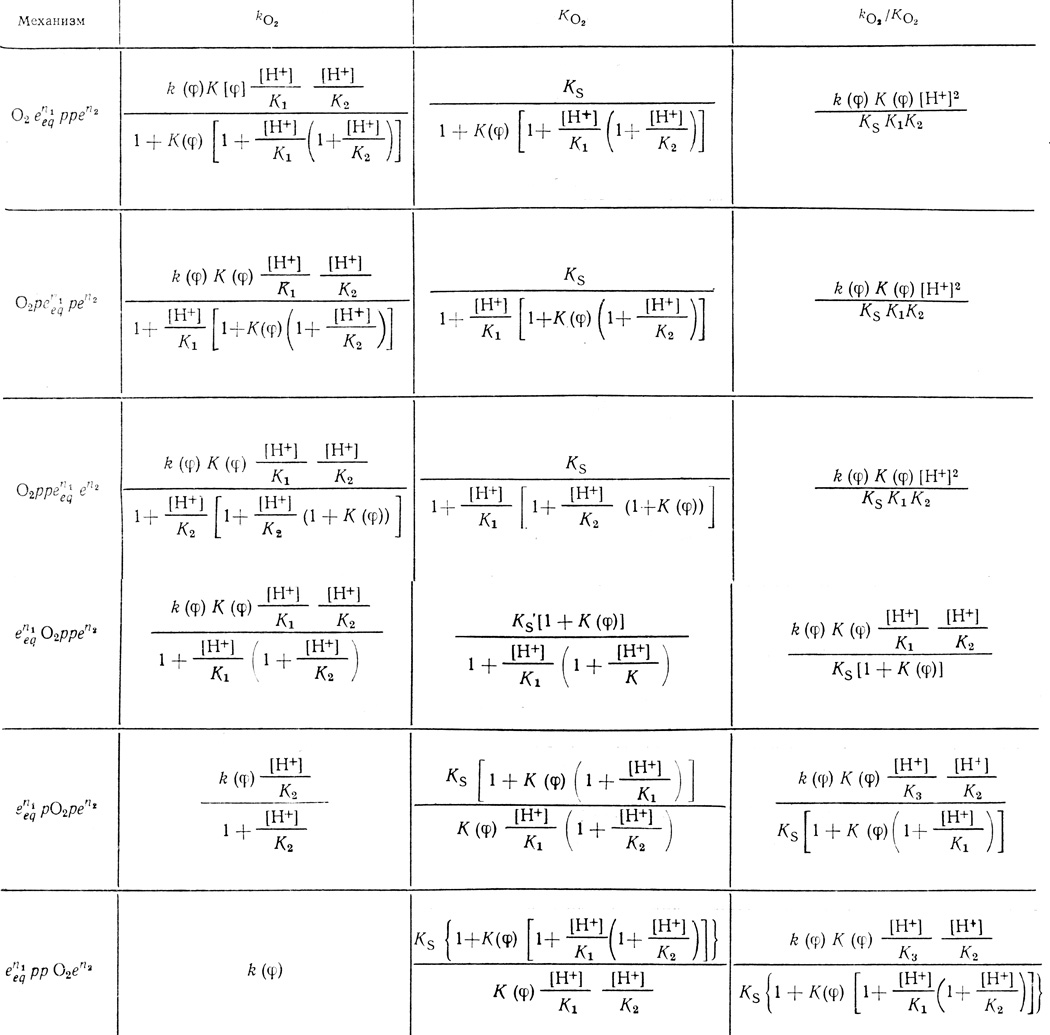
Таблица 38. Кинетические параметры реакций, включающих две стадии протонирования и равновесную стадию переноса электрона
Аналогично можно рассмотреть различные группы механизмов и показать, что "михаэлисовская" зависимость скорости реакции от концентрации субстрата может наблюдаться лишь в условиях участия в механизме реакции внутримолекулярной стадии.
Введение в механизм реакции внутримолекулярной стадии приводит к зависимости скорости реакции, описываемой классическим уравнением Михаэлиса. В табл. 39 приведены простейшие механизмы, включающие стадии присоединения протона К1, электрона k1, кислорода KS и стадию внутримолекулярного процесса, характеризуемую константой скорости kT. Каталитические константы по донору и кислороду обозначены соответственно kD и kO2, значения констант Михаэлиса - КD и KO2.
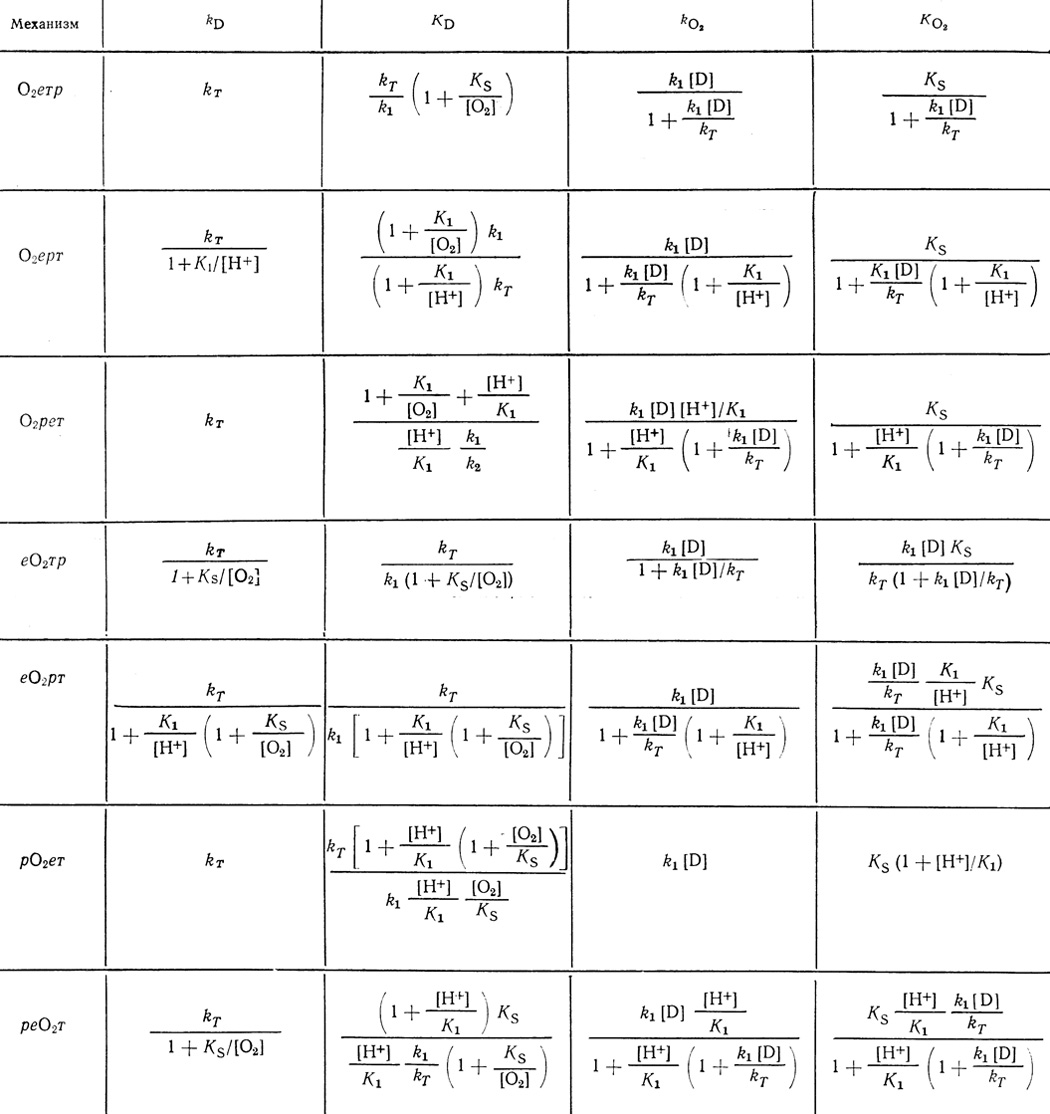
Таблица 39. Кинетические характеристики реакций, включающих стадии протонирования электронного транспорта и мономолекулярной перегруппировки
Таким образом, экспериментально наблюдаемая зависимость скорости реакции от концентрации донора указывает на то, что механизм катализа включает мономолекулярный процесс, протекающий в активном центре фермента на пути превращения кислорода в две молекулы воды. Максимальная скорость реакции при вариации концентрации донора определяется константой скорости этого перехода и (см. табл. 39) не зависит от природы донора. Это согласуется с экспериментальным фактом (см. рис. 87).
Принципиальным является объяснение с точки зрения одной модели pH-зависимости величин kD и КD (см. рис. 87). Величина kD для ферроцианида и гидрохинона зависит от pH и контролируется двумя ионогенными группами с рК 5,5 (в области pH 6-8 ∂ lg υмакс/∂ pH 2). По-видимому, до скорость определяющей стадии протекают по крайней мере две стадии присоединения протона. В то же время значения КD для двух исследованных субстратов pH-независимы. Это представляется. достаточно нетривиальным, поскольку pH-функция, входящая в значение kкат должна также проявляться и в зависимости от pH величины КM (см. табл. 38, 39).
Анализ показывает, что наблюдаемая pH-зависимость КM реализуется при компенсации pH-функций, входящих в эту величину. Рассмотрим достаточно общую модель процесса, включающую две кинетические стадии присоединения электрона и одну стадию внутримолекулярного электронного транспорта. При этом предполагается, что лимитирующим стадиям предшествует ряд быстрых равновесных процессов.
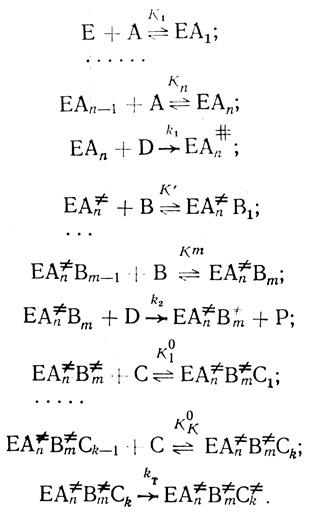 (4.57)
(4.57)В схеме (4.57) индексом А обозначен эффектор, предшествующий первой кинетической стадии, В - второй, С - третьей. Компоненты А, В, С заданы постоянными концентрациями и могут представлять собой ионы водорода, ингибиторы или активаторы фермента. Уравнение скорости для механизма может быть представлено в виде:
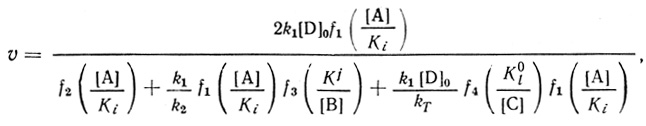 (4.58)
(4.58)где
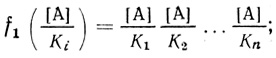 (4.59)
(4.59)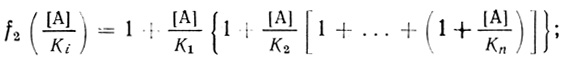 (4.60)
(4.60)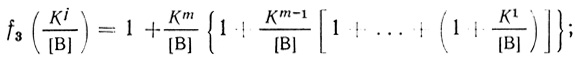 (4.61)
(4.61)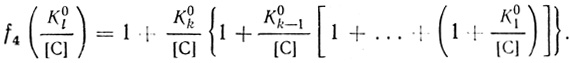 (4.62)
(4.62)Соответственно каталитическая константа и константа Михаэлиса, найденные из зависимости скорости реакции от концентрации донора, равны:
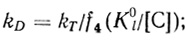 (4.63)
(4.63)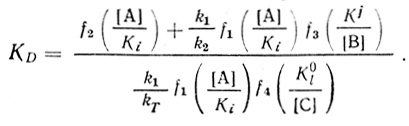 (4.64)
(4.64)В параметр КD входят лишь константы равновесия и концентрации компонентов, стадий, расположенных между двумя последними кинетическими стадиями k2 и kT (см. схему 4.67). На основе уравнения (4.58) можно объяснить независимость КD от pH в условиях, когда зависимость kD от pH проявляется достаточно четко. Действительно, при f2 << k1/k2f1f3
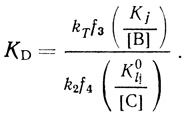 (4.65)
(4.65)Если [В] и [С] представляют собой концентрацию ионов водорода и соблюдаются соотношения
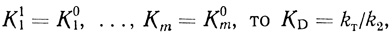
т. е. эффективная константа Михаэлиса не является функцией концентрации ионов водорода.
Проведенный анализ pH-зависимости, по-видимому, одно из немногих объяснений наблюдаемого феномена рН-зависимости kкат и pH-независимости КМ. Можно показать, что сделанные выводы существенно не трансформируются, если в механизм (4.57) добавить еще одну стадию донирования электронов k3, непосредственно следующую за стадией k2.
Результаты проведенного кинетического анализа, основанного на изучении электрохимической кинетики катодного восстановления кислорода и на исследовании стационарной кинетики катализа лакказой реакции окисления органических и неорганических доноров электрона, суммирует схема:
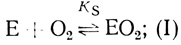 (I)
(I)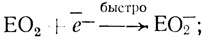 (II)
(II)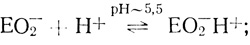 (III)
(III)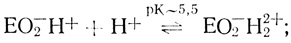 (IV)
(IV)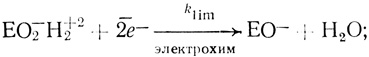 (V) (4.66)
(V) (4.66)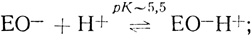 (VI)
(VI)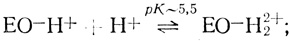 (VII)
(VII)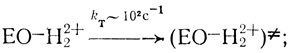 (VIII)
(VIII)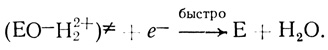 (IX)
(IX)Стадии (I)-(V) постулированы на основе проделанного электрохимического анализа, стадии (VI)-(IX) можно предположить из анализа данных по кинетике гомогенного окисления лакказой субстратов - доноров электрона. Для гомогенного окисления анализ схемы O2еррееррт приводит к уравнению скорости
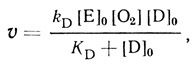 (4.67)
(4.67)где
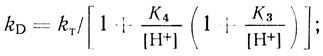 (4.68)
(4.68)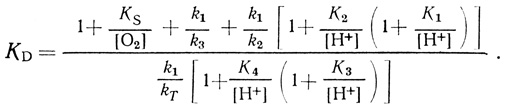 (4.69)
(4.69)Уравнение (4.67) удовлетворяет экспериментальным данным при условиях k1 << k3, k1 > k2, К1 = К3, К4 = К2.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'