
Занятие 14. Сернистый газ, серная кислота
(Занятие проводится в заключение всей темы "Сера". Отводится на него 2 часа)
Работа 1. Получение и изучение свойств сернистого газа.
Оборудование: колбочка на 50 см3 (может быть заменена пробиркой), газоотводная трубка с пробкой, сетка, штатив с кольцом и лапкой, 4-6 пробирок, стойка для них, спиртовка (горелка), стеклянная палочка, стакан с водой, лакмусовая бумажка, магний, раствор едкого натра или кали, концентрированная серная кислота, куски медной проволоки или медные стружки, сернисто-кислый натрий.
Опыт 1. Сернистый газ вы будете получать путём взаимодействия меди с серной кислотой. Напишите уравнение этой реакции.
Соберите прибор, изображённый на рис. 19. В колбу поместите несколько кусочков медной проволоки и добавьте серной кислоты так, чтобы она покрыла металл. Закройте колбу пробкой с газоотводной трубкой и подставьте под последнюю сухую пробирку. Имейте наготове вторую пробирку с водой (Уз пробирки) и третью - с раствором едкого натра.
Нагревайте содержимое колбы, пока не начнёт выделяться газ. Если реакция пойдёт слишком бурно, нагревание следует прекращать и возобновлять после того, как выделение газа замедлится. Наблюдение за спокойным течением реакции необходимо, так как иначе смесь может вспениться и переброситься в пробирку.
Обратите внимание на отсутствие цвета и на специфический запах сернистого газа. Когда вы явно ощутите этот запах, возьмите пробирку из-под газоотводной трубки, сейчас же закройте ее большим пальцем, а под газоотводную трубку подставьте заранее заготовленную пробирку с водой; при этом конец газоотводной трубки не должен быть погружён в воду.
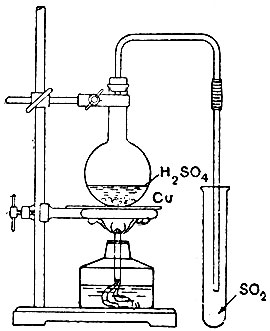
Рис. 19
Опыт 2. Опустите пробирку с сернистым газом горлышком в сосуд с водой, после чего отнимите палец. Наблюдайте засасывание воды в пробирку.
Закройте пробирку с засосавшейся жидкостью пальцем под водой, выньте из воды, переверните и испытайте синей лакмусовой бумагой или раствором лакмуса. Напишите уравнение реакции между сернистым газом и водой.
Опыт 3. Уберите из-под газоотводной трубки пробирку с полученным раствором и замените её заранее заготовленной пробиркой с раствором едкого натра. Конец газоотводной трубки не должен быть погружён в жидкость. Во взятую из-под газоотводной трубки пробирку прибавьте щепотку (или кусочек) магния. Докажите, что выделяющийся газ - водород. Напишите уравнение реакции.
Опыт 4. Напишите равенство реакции взаимодействия сернистого газа с едким натром. Через 3-5 минут после начала поглощения сернистого газа раствором едкого натра прекратите нагревание и разберите прибор. Колбу уберите в вытяжной шкаф (если такового нет, то сдайте преподавателю).
Что должно произойти, если в пробирку с полученным раствором прибавить избыток серной кислоты? Напишите уравнение реакции и проделайте соответствующий опыт. (Газ нюхайте осторожно!)
Работа 2. Свойства серной кислоты.
Оборудование: а) для общего пользования: ареометры, растворы серной кислоты различной концентрации в высоких стеклянных цилиндрах;
б) для индивидуального пользования: 4-6 пробирок, стеклянная палочка, чашка, сетка, штатив с кольцом, спиртовка (горелка), воронка, стакан с водой, концентрированная серная кислота, разбавленная серная кислота, раствор хлористого бария, растворы азотной, соляной и сернистой кислот, растворы солей серной, соляной и сернистой кислот, лучинка.
Опыт 1. По указанию преподавателя определите удельные веса растворов серной кислоты ареометром. По таблице (задачник Гольдфарба и Сморгонского, таблица V) найдите процентное содержание серной кислоты в этих растворах.
Опыт 2. Смочите концентрированной серной кислотой лучинку. Наблюдайте обугливание.
Смочите лучинку разбавленной серной кислотой. Обугливание не наблюдается. Подержите ту же лучинку в тёплом токе воздуха, идущего от пламени спиртовки. Через некоторое время в местах, смоченных серной кислотой, начинается обугливание. Сделайте на клочке бумаги надпись раствором серной кислоты при помощи лучинки или стеклянной палочки. Нагрейте током горячего воздуха - происходит проявление надписи.
Опыт 3. Испытайте в пробирках действие раствора серной кислоты на медь и цинк.
Опыт 4. Для выяснения действия концентрированной серной кислоты на металлы, например, на медь, вспомните проделанный вами опыт получения сернистого газа (работа 1). Чтобы выделить образовавшуюся при этом опыте соль, получите у преподавателя колбу, которую вы сдали (или убрали в вытяжной шкаф), перенесите её содержимое в стакан с водой (3/4 пробирки), размешайте стеклянной палочкой и отфильтруйте в чашку. Упарьте полученный раствор до 1/3 первоначального объёма, перелейте в пробирку и охладите, погрузив в стакан с водой. Наблюдайте кристаллизацию соли.
Опыт 5. Испытайте в пробирках действие раствора хлористого бария на растворы серной, соляной и азотной кислот. Напишите уравнение реакции.
Испытайте в пробирках действие хлористого бария на растворы солей серной, соляной и сернистой кислот. Испытайте отношение полученных осадков к соляной кислоте. Напишите уравнения реакций, ведущих к образованию осадков, а также реакций между соляной кислотой и сернистокислым барием.
Примечание. Осадок сернисто кислого бария растворим в соляной кислоте. Сернисто кислый натрий на воздухе постепенно окисляется, переходя в сернокислый натрий; поэтому продажная соль обычно всегда содержит примесь сернокислого натрия. Это обстоятельство следует принять во внимание при заключениях из опыта 5. Обычно при добавлении соляной кислоты к полученному осадку наблюдается лишь уменьшение количества последнего.
Задача.
Получите у преподавателя пробирки с неизвестными растворами и определите, где серная кислота (или её соль) и где соляная кислота (или её соль).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'