
Занятие 15. Соединения азота
(Все три работы рассчитаны на 2 часа. Проводятся в заключение темы "Азот".)
Работа 1. Получение и изучение свойств аммиака.
Оборудование: штатив с лапкой, 2 пробирки, газоотводная трубка с пробиркой, спиртовка, 2 лучинки, стакан (или простоквашница) с водой, лакмусовая бумага, хлористый аммоний, гашёная известь (или натронная известь), концентрированная соляная и азотная кислоты.
1. Напишите уравнение реакции получения аммиака путём взаимодействия хлористого аммония с гашёной известью.
2. На листке бумаги (или лучше в ступке) тщательно перемешайте равные по объёму количества хлористого аммония и гашёной извести. Вещества возьмите в таких количествах, чтобы смесью можно было наполнить пробирку на одну треть.
Понюхайте полученную смесь.
3. Пересыпьте приготовленную вами смесь в пробирку а (рис. 20) и укрепите последнюю наклонно в лапке штатива так, чтобы отверстие пробирки было несколько ниже дна.
Закройте открытый конец пробирки пробкой с газоотводной трубкой, как показано на рисунке.
4. Наденьте на свободный конец трубки сухую пробирку б и начните нагревать смесь. Сначала прогрейте пробирку а, а затем нагрейте только то место, где находится смесь. Обратите внимание на конденсацию паров воды, накапливающейся около пробки.
5. Когда пробирка б наполнится газом, медленно снимите её и, заткнув отверстие пальцем, погрузите в воду.
Отнимите палец под водой и наблюдайте засасывание жидкости в пробирку.
6. Испытайте полученный раствор лакмусовой бумажкой или лакмусом.
7. Поднесите к отверстию газоотводной трубки лучинку, смоченную концентрированной соляной кислотой, и снова нагрейте смесь. Обратите внимание на появление характерного дыма - частичек аммонийной соли.
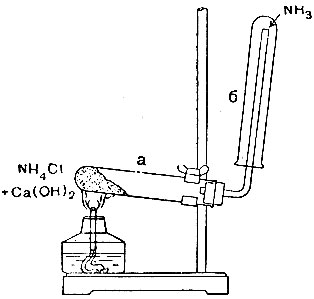
Рис. 20
Проделайте то же самое, взяв вместо соляной кислоты концентрированную азотную кислоту.
Работа 2. Действие азотной кислоты на медь, свойства окислов азота.
Оборудование: штатив с лапкой, 2 пробирки, газоотводная трубка с пробиркой, спиртовка (или газовая горелка), стакан (или простоквашница) с водой, запас-воды, лакмусовая бумажка, медь, разведённая азотная кислота (1 : 1).
1. Напишите уравнение реакции между медью и разбавленной азотной кислотой..
2. В пробирку а (рис. 21) поместите 2-3 кусочка медной проволоки и добавьте разведённой азотной кислоты.
Если реакция пойдёт слишком медленно, слегка подогрейте смесь. Через некоторое время, когда воздух из прибора будет вытеснен, начните собирать газ в другую пробирку (заготовить заранее) методом вытеснения воды.
3. Когда пробирка б будет наполнена окисью азота, выньте газоотводную трубку из воды.
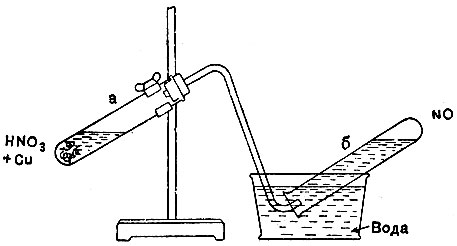
Рис. 21
Заткнув пробирку с газом под водой пальцем, выньте её из воды. Поместите за пробиркой листок белой бумаги для того, чтобы лучше заметить изменение окраски. Откройте отверстие пробирки. Наблюдайте изменение окраски. Напишите соответствующее равенство реакции.
4. Когда содержимое пробирки побуреет, прилейте небольшое количество воды, заткните отверстие пальцем и энергично взболтайте. При этом бурая окраска исчезает, а пробирка присасывается к пальцу.
5. Испытайте полученную жидкость лакмусовой бумажкой.
6. Обратите внимание на окраску жидкости в пробирке а.
Работа 3 (задачи). Определение солей аммонии.
Оборудование: пробирки, 10% раствор щёлочи, раствор хлористого (или азотнокислого) бария, раствор азотнокислого серебра, лакмусовая бумажка.
Предварительный опыт. К раствору соли аммония (1/10 пробирки) прибавьте равный объём 10% раствора щёлочи и подогрейте до кипения. Определите по запаху присутствие аммиака. Поднесите к отверстию пробирки влажную красную лакмусовую бумажку. Объясните изменение окраски лакмуса.
Задача.
Получите у преподавателя неизвестное вещество и выясните да опыте:
а) Является ли данное вещество солью аммония?
б) Является ли данное вещество солью серной или соляной кислоты?
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'