
Занятие 16. Угольная кислота и её соли
(Работа рассчитана на 2 часа. Проводится в заключение темы "Углерод и кремний".)
Оборудование: прибор для получения углекислого газа, 3 банки (или цилиндра), лучинка, спиртовка, спички, крахмал, раствор соляной кислоты, раствор серной кислоты, раствор лакмуса, растворы азотной кислоты, азотнокислого серебра и хлористого бария; кристаллические соли: Na2CO3, CaCO3, MgCO3.
Работа 1. Получение и ознакомление со свойствами углекислого газа.
Опыт 1. Углекислый газ вы будете получать путём действия соляной кислоты на мрамор. Напишите уравнение этой реакции.
1. Для получения углекислого газа воспользуйтесь одним из приборов, изображённых на рис. 22 (по указанию учителя). Соберите прибор из имеющихся у вас деталей.
2. В прибор поместите кусочки мрамора и прилейте соляной кислоты. Выделяющийся газ собирайте в небольшие банки. При помощи горящей лучинки испытывайте, наполнилась ли банка углекислым газом. Наполните таким образом 2 банки. Банки, наполненные газом, прикройте куском картона.
3. Прибавьте к воде в пробирке несколько капель фиолетового лакмуса. Полученный раствор разлейте в две пробирки. Погрузите газоотводную трубку прибора в одну из пробирок, а вторую оставьте для сравнения. Пока вода будет насыщаться углекислым газом, приступите к следующим опытам.
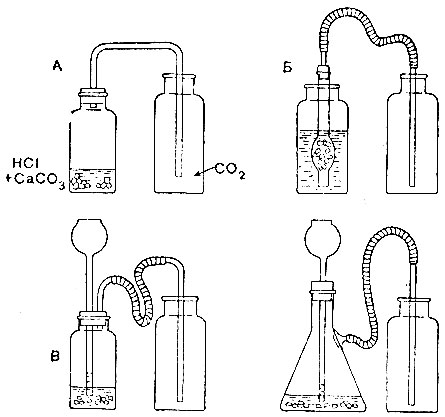
Рис. 22
Опыт 2. Из второй банки медленно перелейте углекислый газ в другую банку и докажите присутствие в последней углекислого газа, испытав его горящей лучинкой.
Опыт 3. Сравните окраску раствора, насыщенного углекислым газом (см. опыт 1, п. 3), с окраской первоначально взятого раствора.
Подогрейте раствор, насыщенный углекислым газом. Обратите внимание на выделение пузырьков газа и изменение окраски. Объясните результаты этого опыта.
Опыт 4. Ознакомьтесь с действием выставленного на столе преподавателя автоматического аппарата для получения углекислого газа (аппарат Киппа). При закрытом кране жидкость не спускается в аппарат. Откройте кран и наблюдайте происходящие явления. Почему жидкость вновь поднимается в верхний шар, если кран закрыт? Зарисуйте аппарат и опишите, как он действует.
Работа 2. Свойства солей угольной кислоты.
Опыт 1. Поместите в пробирки понемногу (с горошину) углекислых солей натрия, магния, кальция. Прилейте по 1 см3 соляной кислоты и исследуйте, горит ли в ней лучинка. (Уравнения реакций.)
Повторите опыт, взяв вместо соляной кислоты серную. Обратите внимание, как идет реакция между серной кислотой и углекислым кальцием. Пользуясь таблицей растворимости солей, объясните, почему реакция быстро прекращается.
Опыт 2. К раствору какой-либо соли угольной кислоты (в пробирке) прибавьте раствор какой-либо кислоты - соляной, азотной или серной. Наблюдайте выделение газа.
Опыт 3. К 1-2 см3 раствора карбоната натрия прибавьте избыток раствора хлористого бария. Выпадает объёмистый осадок. Прибавьте разбавленной азотной или соляной кислоты до растворения осадка. Напишите уравнения реакций образования осадка и его растворения в кислоте.
Опыт 4. К 1-2 см3 раствора карбоната натрия прибавьте равный объём раствора азотнокислого серебра. Выпадает осадок (уравнение реакции). Убедитесь в том, что осадок растворяется в разбавленной азотной кислоте (уравнение реакции).
Задачи.
1. Определите, солью какой кислоты - серной, соляной или угольной - является имеющееся в пробирке 1 твёрдое кристаллическое вещество.
2. В пробирках 2, 3 и 4 находятся: в одной - раствор соли соляной, в другой - серной, в третьей - угольной кислоты. Определите, в какой пробирке соль какой кислоты находится.
3. Докажите, применив имеющиеся на столе реактивы, не употребляя индикатора, что в пробирке 5 находится раствор кислоты.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'